§ 36. Електричний струм у розчинах і розплавах електролітів. Закон Фарадея
Ви дізнаєтесь
Особливості електричного струму в рідких середовищах
Пригадайте
Умови існування електричного струму
Що таке анод і катод
Природа електричного струму в розчинах і розплавах електролітів. Ще на початку вивчення електричного струму (§ 24) було зазначено, що залежно від агрегатного стану речовини розрізняють особливості існування електричного струму, зокрема в металах, рідинах і газах, де носіями струму можуть бути вільні електрони, позитивні й негативні йони. До цього часу ми вивчали закономірності існування електричного струму в металевих провідниках і знаємо, яке велике практичне значення має це явище. Настав час дослідити особливості утворення й існування струму в інших середовищах.
Багато речовин у твердому стані мають йонну структуру (хлористий натрій і деякі інші солі). Але у твердому стані йони міцно зв’язані один з одним, оскільки мають протилежні електричні заряди, тому їх рухливість ускладнена. Досліди показують, що під час нагрівання (у розплавленому стані) деякі солі та оксиди металів можуть розпадатися на окремі йони. У розплаві такої речовини рухливість йонів збільшується. А найбільшою вона буде, якщо таку речовину розчинити у воді. У розчині речовина розпадається на позитивно та негативно заряджені йони під впливом молекул води. Розщеплення речовини на йони у водному розчині або в розплаві називають електролітичною дисоціацією, а такі речовини — електролітами.
Електроліти — це речовини, водні розчини або розплави яких проводять електричний струм.
Типовими електролітами є солі, кислоти й луги, багато органічних сполук.
Проведемо дослід. З’єднаємо послідовно джерело струму, електричну лампочку та два електроди (анод — електрод, приєднаний до позитивного полюса джерела
струму, та катод — електрод, приєднаний до негативного полюса джерела струму). Звичайно ж, лампочка світитися не буде, оскільки електричне коло розімкну те. Додамо у склянку кухонну сіль NaCl та опустимо в неї електроди (мал. 174, а). Лампочка знову не світиться, оскільки кухонна сіль є діелектриком.
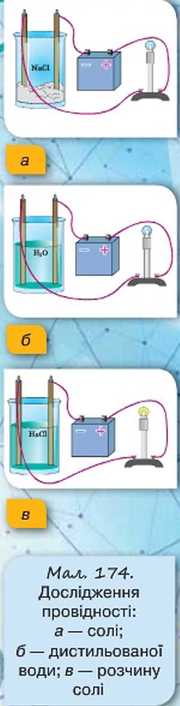
Зануримо тепер електроди в ємність із дистильованою водою (мал. 174, б). Лампочка знову не світиться, оскільки дистильована вода також є діелектриком. Додамо трохи солі в посудину з водою. Ми побачимо, що лампочка почне світитися, а отже, в колі з’явився електричний струм (мал. 174, в).
Результати досліду підтверджують той факт, що в розчині з’являються носії струму. За відсутності зовнішнього електричного поля йони разом із молекулами, які не розпалися на йони, перебувають у безперервному хаотичному русі. Що ж відбувається, якщо в розчин електроліту поміщають два електроди? Оскільки електроди різнойменно заряджені, то між ними виникає електричне поле. Очевидно, що позитивні йони (їх ще називають катіони) почнуть рухатися до негативно зарядженого електрода — катода, а негативні йони (аніони) — до позитивно зарядженого електрода, тобто до анода. У колі виникає електричний струм, зумовлений напрямленим рухом електричних зарядів обох знаків.
Електричний струм у розчинах електролітів — це впорядкований рух йонів.
Давайте поміркуємо над тим, а як же залежить провідність розчинів і розплавів електролітів від температури. Пригадайте такий факт: цукор чи сіль значно легше розчиняється в гарячій воді, ніж у холодній. Отже, з підвищенням температури зростає кількість молекул, які розпадаються на йони, тобто кількість вільних носіїв електричного заряду збільшується. Що більшою буде кількість вільних носіїв заряду, то краще речовина проводить електричний струм. Отже, очевидним є висновок: зі збільшенням температури розчинів і розплавів електролітів їх провідність збільшується, а опір відповідно зменшується.
Електроліз. Досліджуючи дії струму (§25) ми вже згадували про хімічну дію струму. Дослідимо її детальніше.
У розчині під дією електричного поля до катода рухаються позитивно заряджені йони (катіони), які при кон-
такті з катодом нейтралізуються, приєднавши відповідну кількість електронів. Нейтральні атоми, що утворилися, осідають на електроді у вигляді твердого шару або виділяються в газоподібному стані.
Водночас аніони (негативно заряджені йони), досягши поверхні анода, навпаки, «віддають» йому надлишкові електрони і також нейтралізуються.
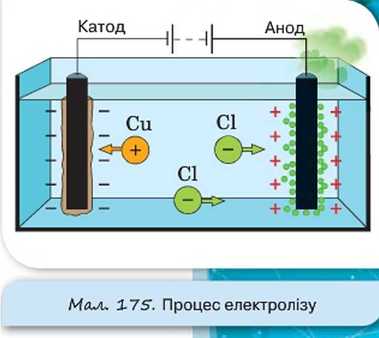
Розглянемо приклад. Хлорид міді CuCl2 дисоціює у водному розчині на йони міді та хлору:
CuCl2 <-» Cu"* + 2СГ.
У разі підключення електродів до джерела струму йони під дією електричного поля починають упорядкований рух: додатні йони міді рухаються до катода, а від’ємні йони хлору — до анода (мал. 175).
Досягнувши катода, йони міді нейтралізуються його надлишковими електронами та перетворюються в нейтральні атоми, які виділяються (осідають) на катоді. Відбувається хімічна реакція відновлення: Cu2+ + 2е -» Cu. Йони хлору, досягнувши анода, віддають по одному електрону. Відбувається хімічна реакція окислення: 2С1” —» Cl2 + 2е. (Окислювач — речовина, до складу якої входять атоми, що приєднують електрони під час хімічної реакції). Після цього нейтральні атоми хлору з’єднуються попарно й утворюють молекули хлору Cl2. Хлор виділяється на аноді у вигляді бульбашок газу.
Бачимо, що, на відміну від металів, під час проходження електричного струму крізь електроліт на електродах виділяється речовина (у нашому прикладі — мідь і хлор). Такий процес називають електролізом.
Електроліз — це процес виділення речовини на електродах під час проходження електричного струму крізь розчини або розплави електролітів.
Закон Фарадея для електролізу. У 1833-1834 рр. видатний англійський учений Майкл Фарадей експериментально встановив кількісні співвідношення, що описують явище електролізу. Закон Фарадея для електролізу дає змогу обчислити масу речовини, яка виділяється на електроді.
Закон Фарадея
Маса речовини т, що виділилася на електроді в результаті електролізу, прямо пропорційна силі струму І і часу t проходження струму через електроліт:
т = kit,
де k — коефіцієнт пропорційності (електрохімічний еквівалент).
Електрохімічний еквівалент речовини дорівнює масі цієї речовини, що виділяється на електроді за 1 с під час проходження через електроліт струму силою 1 А.
Значення електрохімічного еквіваленту найбільш поширених речовин подано в таблиці на форзаці підручника.
Використання електролізу. Явище електролізу застосовується в сучасній техніці. Розглянемо деякі приклади.
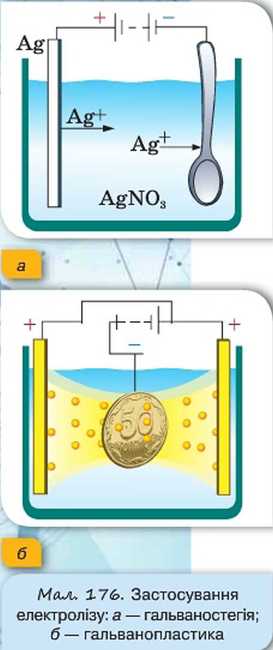
Деталі технічних пристроїв, деякі частини предметів побуту інколи покривають тонкою плівкою благородного металу (платина, золото, срібло) з декоративно-естетичною метою або з метою запобігання корозії. Такий процес називається гальваностегія (від гальвано і грец. Stego — покриваю). У техніці, аби уникнути корозії, окремі деталі різних пристроїв покривають нікелем, хромом, кадмієм.
Деталь заздалегідь ретельно очищають і поміщають в електролітичну ванну, наповнену водним розчином солі відповідного металу, та сполучають із негативним полюсом джерела струму. Анодом слугує пластинка з того самого металу. У результаті електролізу на поверхні деталі осідає шар металу, сіль якого міститься в розчині електроліту (мал. 176, а).
Використовуючи явище електролізу, можна отримати абсолютно точні рельєфні копії предметів (наприклад, монет, медалей, ювелірних прикрас тощо). Для цього з предмета спочатку роблять зліпок з якого-небудь пластичного матеріалу (наприклад, із воску). Потім поверхню цього зліпка роблять електропровідною, покриваючи її тонким шаром електропровідної речовини. Підготовлений у такий спосіб зліпок поміщають в електролітичну ванну як катод (мал. 176, б). У процесі проходження через ванну електричного струму зліпок покривається
товстим шаром металу. За допомогою гальванопластики виготовляють, наприклад, точні копії дорогоцінних прикрас, знайдених археологами.
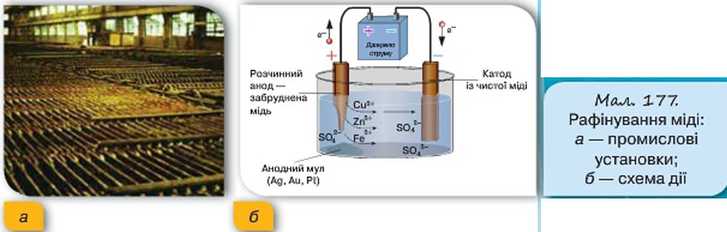
Процес рафінування (очищення) металів також ґрунтується на явищі електролізу. На малюнку 177 показано, як очищують (рафінують) мідь. З цією метою пластини із забрудненого металу занурюють в електроліт, який містить солі цього металу та інші необхідні компоненти, і підключають до позитивного полюса джерела струму. До негативного підключають електрод із чистого металу. Унаслідок проходження електричного струму відбуваються хімічні реакції: на катоді осідає чиста мідь, домішки випадають в осад. Осад містить домішки золота та срібла і є джерелом їх добування.
Підбиваємо підсумки
Розщеплення речовини на йони у водному розчині або в розплаві називається електролітичною дисоціацією.
Речовини, водні розчини або розплави яких проводять електричний струм, називаються електролітами.
Електричний струм у розчинах електролітів — це впорядкований рух йонів.
На відміну від металів, під час проходження електричного струму крізь електроліт на електродах виділяється речовина. Такий процес називається електролізом.
Для електролізу встановлено закон Фарадея: маса речовини т, що виділилася на електроді в результаті електролізу, прямо пропорційна силі струму І і часу t проходження струму через електроліт: т = kit, де /г — коефіцієнт пропорційності (електрохімічний еквівалент).
Явище електролізу застосовується в сучасній техніці.
А знаю, вмію та можу пояснити·
1. Що називають електролітами? Чому кристали з йонним зв’язком є електролітами?
2. Поясніть механізм виникнення струму в електролітах.
3. Що називають електролізом?
4. Сформулюйте закон Фарадея.
5. У чому полягає фізичний зміст електрохімічного еквіваленту речовини?
ПОЯСНІТЬ
1. Чому електроліт у розчині чи розплаві є електрично нейтральним, хоча він містить величезну кількість йонів обох знаків?
2. За яких умов у посудині з електролітом, де є носії струму обох знаків, струму немає?
3. Чому під час проходження струму крізь електроліт на електродах виділяється чиста речовина, що входить до складу електроліту?
4. У чому полягає відмінність між негативним йоном в електроліті й електроном?
ВЧИМОСЯ РОЗВ'ЯЗУВАТИ ЗАДАЧІ
Під час електролізу сталеву деталь площею поверхні 800 см“ було вкрито шаром нікелю товщиною 54 мкм. За якої сили струму проходив процес, якщо електроліз тривав 4 год?
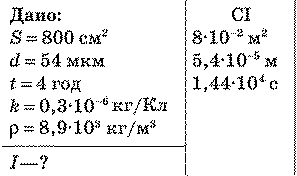
Розв'язання:
Під час електролізу маса речовини, що виділяється з розчину електроліту, визначається за формулою: m = klt.
Масу речовини можна визначити за значенням її густини:
т=pV=рSd.
Прирівнюючи формули, визначаємо силу струму:
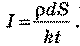

1. У розчині електроліту внаслідок проходження заряду 1 Кл на катоді виділяється 1,118 мг срібла. Визначте масу срібла, що виділиться внаслідок проходження електричного заряду 500 Кл.
2. Під час електролізу розчину цинк сульфату виділилося 2,45 г цинку. Визначте електрохімічний еквівалент цього металу, якщо крізь електроліт протягом 60 хв проходив електричний струм 2 А.
3. Якою була сила струму під час електролізу розчину мідного купоросу, якщо за 50 хв на катоді виділилося 1,98 г міді?
4. Під час посріблення виробу на катоді за ЗО хв осіло 4,55 г срібла. Визначте силу струму під час електролізу.
5. Під час електролізу необхідно затратити 2 кВт-год енергії. Визначте масу цинку, яка в цьому разі виділиться, якщо напруга на клемах становить 4 В.
6. Скільки часу тривало нікелювання, якщо на виробі осів шар нікелю масою 1,8 г? Сила струму становила 2 А.
7. У разі пропускання через електроліт струму силою 1,5 А за 5 хв на катоді виділяється 137 мг деякої речовини. Що це за речовина?
Це матеріал з Підручника Фізика 8 Клас Засєкіна
Автор: evg от 7-08-2016, 17:55, Переглядів: 7360