§ 38. Застосування електролізу
Існує легенда, що наприкінці XVIII ст. король Англії надіслав у подарунок російській імператриці Єкатерині II... алюмінієвий кухоль. Зараз це складно навіть уявити, але вона була вражена таким коштовним подарунком! Річ у тім, що в ті часи алюміній був дуже рідкісним і коштував у кілька разів дорожче від золота. Згодом завдяки застосуванню електролізу алюміній став загальнодоступним і досить недорогим. Про те, як за допомогою електролізу одержують метали і де ще застосовують електроліз, ітиметься в цьому параграфі.
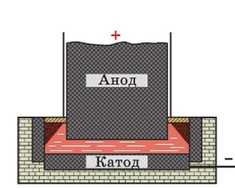
Рис. 38.1. Виробництво алюмінію (схема промислового пристрою). Дно та стінки ванни слугують катодом; алюміній збирається на дні ванни. Вугільні блоки слугують анодом, на них виділяється кисень
Застосовуємо електроліз для одержування металів
Електроліз широко застосовують у промисловості. За допомогою електролізу із солей і оксидів одержують багато металів: мідь, нікель, алюміній та ін. Наприклад, щоб одержати алюміній, як електроліт викори-
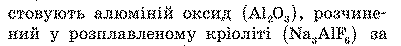
температури 950 С. Розчин поміщають у спеціальні електролітичні ванни; катодом зазвичай слугують дно та стінки ванни, викладені графітом, а анодом — занурені в електроліт вугільні блоки (рис. 38.1). Під час пропускання струму через електроліт на катоді виділяється алюміній.
Одержуємо чисті метали
Метали, отримані шляхом електролізу (або іншим способом), зазвичай містять деяку кількість домішок, оскільки сировина не може бути «ідеальною». Так, у розплаві завжди наявні солі й оксиди інших металів, які так само можуть виділятися на катоді. Для очищення металів від домішок можна знову використати електроліз.
Спосіб очищення металів за допомогою електролізу називають рафінуванням.
У такий спосіб очищають мідь, алюміній, свинець, срібло та деякі інші метали. Наведемо приклад. У ванну з розчином купрум сульфату

да й поступово розчиняють його. А катіони Купруму прямують до катода й осідають на ньому. У результаті чиста мідь переноситься з анода на катод, а домішки осідають на дні або залишаються в розчині.
Знайомимося з гальваностегією
Шляхом електролізу можна наносити тонкий шар металу на поверхню виробу — робити сріблення, золочення, нікелювання, хромування тощо. Такий шар може захищати від корозії, збільшувати міцність виробу або просто ставати його прикрасою.
Електролітичний спосіб покривання виробу тонким шаром металів називають гальваностегією.
Виріб, який бажають покрити тонким шаром металу, опускають у ванну з розчином електроліту, до складу якого входить потрібний метал. Виріб, що покривається металом, є катодом, а пластинка металу, яким покривають виріб, — анодом. Під час пропускання струму метал осідає на виробі (катоді), а анодна пластинка поступово розчиняється (рис. 38.3).
Вивчаємо гальванопластику
Гальванопластика — це одержання за допомогою електролізу точних копій рельєфних виробів.
Спочатку з воску або іншого пластичного матеріалу роблять зліпок рельєфного виробу. Щоб поверхня зліпка проводила струм, її покривають тонким шаром графіту. Потім зліпок поміщують у ванну з розчином електроліту; зліпок слугуватиме катодом. Анодом буде пластинка металу. Під час електролізу на зліпку нарощується досить товстий шар металу, що заповнює всі нерівності зліпка. Після припинення електролізу восковий зліпок відділяють від шару металу і в результаті отримують точну копію виробу (рис. 38.4).
Зрозуміло, що застосування електролізу в сучасній техніці не обмежене розглянутими прикладами. За допомогою електролізу можна здійснити полірування поверхні анода; електроліз лежить в основі заряджання та розряджання кислотних і лужних акумуляторів тощо.
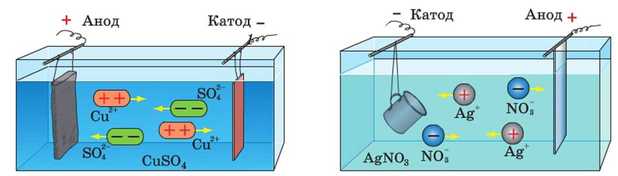
Рис. 38.2. Рафінування міді: тонка пластин- Рис. 38.3. Гальванічне сріблення. Предмет, ка чистої міді є катодом, товста пластинка який покривають сріблом (кухоль), є ка-неочищеної міді — анодом; ванна напов- тодом, срібна пластинка — анодом; ванна нена водним розчином купрум сульфату наповнена розчином аргентум нітрату
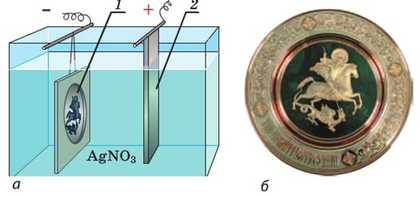
Рис. 38.4. Одержування рельєфних копій за допомогою електролізу: о — схема пристрою: восковий зліпок, покритий тонким шаром графіту, є катодом (7), срібна пластинка — анодом (2); ванна наповнена розчином аргентум нітрату; б — одержана копія
Учимося розв'язувати задачі
Задача. Під час нікелювання на кожний 1 дм2 поверхні виробу, який нікелюють, подають силу струму 0,4 А. За який час на виріб буде нанесено шар нікелю завтовшки 0,2 мм?
Аналіз фізичної проблеми. Час перебігу електролізу можна обчислити за допомогою першого закону Фарадея; масу речовини, що виділилася на катоді, подамо через густину та об’єм шару нікелю. Електрохімічний еквівалент і густину нікелю знайдемо відповідно в табл. 8 і 9 Додатка. Розв’язуючи задачу, густину зручно подати в грамах на кубічний сантиметр, товщину шару — в сантиметрах, площу поверхні — в квадратних сантиметрах, а електрохімічний еквівалент — у грамах на кулон.

Підбиваємо підсумки
Електроліз широко застосовують у промисловості. За допомогою електролізу із солей і оксидів одержують багато металів (мідь, нікель, алюміній та ін.), а також очищують їх. Спосіб очищування металів за допомогою електролізу називають рафінуванням.
Шляхом електролізу можна нанести тонкий шар металу на поверхню виробу (здійснити сріблення, золочення, нікелювання, хромування тощо), виготовити точні копії рельєфних виробів. Електролітичний спосіб покривання виробу тонким шаром металу називають гальваностегією, а отримання за допомогою електролізу точних копій рельєфних виробів — гальванопластикою.
Контрольні запитання
1. Наведіть приклади застосування електролізу. 2. Опишіть процесе одержання алюмінію за допомогою електролізу. 3. Як можна очистити метали від домішок? 4. Для чого поверхню металів покривають тонким шаром іншого металу? 5. Що таке гальваностегія? гальванопластика?
Вправа № 38
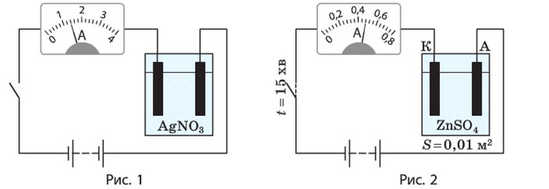
1. На рис. 1 наведено схематичне зображення електричної установки.
1) Назвіть основні складові елементи цієї установки.
2) Який електрод слугує катодом, а який — анодом?
3) На якому електроді виділяється срібло?
4) Якою є сила струму в колі?
5) За який час на електроді утвориться шар срібла масою 2,52 г?
6) Яку енергію буде витрачено під час сріблення, якщо напруга на електродах становить 11 В?
2. На рис. 2 наведено схематичне зображення електричного кола, до складу якого входить посудина з водним розчином цинк сульфату. За даними рисунка обчисліть товщину шару цинку, що утвориться на катоді в результаті електролізу.
3. Для сріблення ложок через розчин аргентум нітрату пропускали струм силою 1,8 А. Катодом слугували 12 ложок, кожна з яких мала площу поверхні 50 см2. Скільки часу тривав електроліз, якщо на ложках утворився шар срібла завтовшки 58 мкм?
4. Під час рафінування міді анодом слугує пластина неочищеної міді масою 2 кг, що містить 12 % домішок. Скільки енергії необхідно витратити для очищення цієї міді, якщо процес відбувається за напруги б В?
5. З наведених речовин і матеріалів виберіть ті, які є: а) провідниками; б) діелектриками: 1) дистильована вода; 2) мідь; 3) повітря; 4) морська вода; 5) золото; 6) ртуть; 7) гума; 8) порцеляна.
Це матеріал з Підручника Фізика 8 Клас Бар'яхтар
Автор: evg от 7-08-2016, 20:25, Переглядів: 11033