§ 34. Природа електричного струму в розчинах і розплавах електролітів
Електроліти. Електролітична дисоціація
Електроліз. Закон електролізу
Застосування електролізу
ЕЛЕКТРОЛІТИ. ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ. Звернемося до досліду. З’єднаємо послідовно джерело живлення, електричну лампочку та два металеві електроди, які зануримо в скляну посудину з кухонною сіллю NaCl (рис. 34.1, а).
Замкнемо електричне коло. Лампочка не світиться, оскільки кухонна сіль є діелектриком. Зануримо тепер електроди в посудину з дистильованою водою (рис. 34.1.6). Лампочка знову не світиться, тому що дистильована вода також є діелектриком. Розчинимо трохи солі у воді та повторимо дослід. Побачимо, що
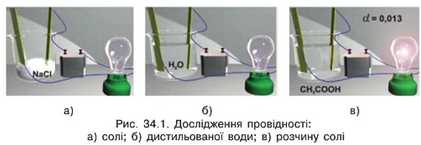
лампочка почне світитися. Отже, в колі з’явився електричний струм (рис. 34.1, в).
Таким чином, розчин кухонної солі проводить електричний струм. Речовини, розчини і розплави яких проводять електричний струм, називають електролітами. До електролітів належать речовини, в яких електричний струм утворюється йонами, зокрема розплавлені солі, водні розчини солей, кислот і лугів тощо.
У попередніх параграфах ви дізналися про особливості електричного струму в металах та напівпровідниках. Які ж процеси відбуваються в електролітах під час проходження електричного струму?
Молекули солей, кислот і лугів утворені позитивними й негативними йонами, які утримуються силами електростатичного притягання. Наприклад, у молекулах кам’яної солі NaCl позитивно заряджений йон натрію Na+ притягується до негативного йона хлору СІ". У водяному розчині молекули солі NaCl потрапляють в оточення полярних молекул води (рис. 34.2). Своїми позитивними полюсами молекули води наближаються до йонів хлору CI', а негативними —
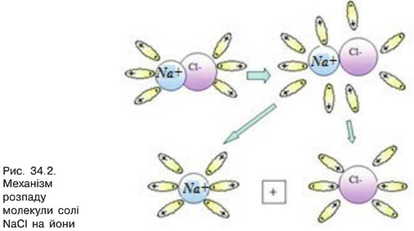
до йонів натрію Na+. У певний момент сила притягання між цими йонами і молекулами води переважає над силою притягання між йонами, і молекула солі розпадається на два йони СІ" та Na+.
Процес розпаду молекул на йони називається електролітичною дисоціацією.
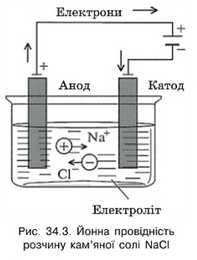
Носіями заряду в електролітах є йони, тобто електроліти мають йонну провідність. Зі збільшенням температури концентрація позитивно й негативно заряджених іонів збільшується.
За відсутності зовнішнього електричного поля йони разом з молекулами, які ще не розпалися, перебувають у безперервному хаотичному русі.
Якщо ємність із розчином електроліту підключити до електричного кола, то між електродами утворюється електричне поле і йони в розчині почнуть рухатися напрямлено. Позитивно заряджені йони будуть рухатися до електрода, з’єднаного з негативним полюсом джерела живлення, тобто до катода, а негативні йони — у протилежному напрямі, до анода (рис. 34.3). При цьому через розчин електроліту відбувається перенесення як заряду, так і речовини. Провідність, зумовлену pj^xom йонів, називають йонною.
Пригадайте з досвіду: цукор чи сіль значно легше розчиняється в гарячій воді, ніж у холодній. Тобто з підвищенням температури зростає кількість молекул, які розпадаються на йони, а отже число вільних носіїв електричного заряду збільшується. Чим більшою буде кількість вільних носіїв заряду, тим краще речовина проводить електричний струм.
Таким чином, із підвищенням температури розчинів і розплавів електролітів їх провідність збільшується, а опір, відповідно, зменшується.
ЕЛЕКТРОЛІЗ. ЗАКОН ЕЛЕКТРОЛІЗУ. Проходження електричного струму через електроліт пов’язане з перенесенням речовини. На електродах відбувається виділення речовин, що входять до складу електролітів.
Процес виділення речовини на електродах під час проходження електричного струму через електроліт називають електролізом.
Явище електролізу відкрив та дослідив Майкл Фарадей. Він з'ясував, що на аноді негативно заряджені йони віддають зайві електрони (у хімії цей процес називається окисною реакцією), а на катоді позитивні йони одержують відсутні електрони (відновна реакція).
Кожний іон, що у процесі електролізу нейтралізується на електроді й виділяється на ньому у вигляді нейтрального атома, має певну масу. Але разом із тим він переносить через електроліт не тільки масу, а й певний заряд. Тому маса речовини, що виділилася на електроді, та кількість електрики, яка пройшла через електроліт, залежать від кількості йонів, що дісталися електродів.
У 1833 р. М. Фарадей установив законмірність, яка отримала назву закону Фарадея:
Маса речовини т, яка виділилась на електроді під час електролізу, прямо пропорційна заряду q, який пройшов через електроліт:
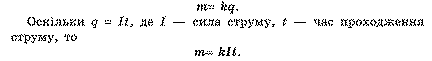
Сталу k називають електрохімічним еквівалентом речовини. Він залежить від природи речовини та чисельно дорівнює масі речовини в кілограмах, яка виділяється під час проходження 1 Кл електрики.
Значення електрохімічного еквівалента найпоширеніших речовин можна знайти в довідниковій таблиці (табл. 34.1).
Таблиця 34.1
Електрохімічні елементи речовин
|
Речовина |
Електрохімічний еквівалент, мг/Кл |
|
Алюміній |
0,093 |
|
Водень |
0,0104 |
|
Кисень |
0,083 |
|
Мідь |
0,33 |
|
Нікель |
0,3 |
|
Срібло |
1,12 |
|
Хром |
0,18 |
|
Цинк |
0,34 |
ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ. На межі ХУШ і XIX ст. італійський фізіолог Луїджі Гальвані й англійський фізик Алессандро Вольта зробили відкриття, які започаткували нову наукову галузь — електрохімію. Учені з’ясували, що під час проходження електричного струму через водний розчин солі в ньому відбуваються хімічні перетворення, які нині називають електролітичними. Пізніше російський учений Б. С. Якобі винайшов спосіб нанесення шару металу на поверхню різних виробів за допомогою електричного струму.
Сьогодні електроліз набув широкого застосування в техніці. Його використовують у технології рафінування (очищення) металів від домішок. За допомогою електролізу в електрометалургії отримують чистий натрій, нікель, кисень, водень, хлор та інші речовини. Пластина металу, який підлягає очищенню, є анодом, що разом із катодом занурюється в електролітичну ванну, заповнену водним розчином солі цього металу. Під час електролізу метал анода у вигляді йонів переходить у розчин і далі відкладається на катоді. Електролітичний спосіб рафінування застосовується, наприклад, для отримання електротехнічної міді, з якої виготовляють електричні провідники. Зокрема, із руди з різноманітними домішками відливають мідні пластини, які приєднуються до анода й вміщуються в розчин сульфату міді (CuSO4). Під час пропускання електричного струму на катоді виділяється чистий метал, а всі сторонні домішки випадають в осад або переходять в електроліт.
За допомогою електролізу одні метали вкривають шаром іншого. Цей процес називається гальваностегією. Так, поверхні виробів із заліза вкривають нікелем або хромом, які мають значно вищу стійкість до корозії.


Явище електролізу покладено в основу гальванопластики — отримання металевих копій різних предметів (медалей, монет, барельєфів, матриць для друкованих електричних плат) (рис. 34.4). Для цього з пластичного матеріалу, такого, наприклад, як віск, виготовляється копія предмета. Потім її вкривають графітовим пилом, щоб надати поверхні копії електропровідності й вміщують у ванну, де вона є катодом. У процесі електролізу ця копія вкривається шаром металу потрібної товщини. А віск (пластичний матеріал) потім видаляється шляхом нагрівання.
На виробництві процеси гальваностегії та гальванопластики проводять у гальванічних цехах, використовуючи великі гальванічні ванни, до яких одночасно можна вміщувати значну кількість виробів (рис. 34.5).
Хмельницький машинобудівний завод «ТЕМП» виготовляє сучасне гальванічне обладнання, що використовується як в Україні, так і в інших країнах (рис. 34.6).

ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ФІЗИЧНИХ ЗАДАЧ НА ЕЛЕКТРОЛІЗ
Задача 1. Визначте масу срібла, що виділилося на катоді при електролізі азотнокислого срібла за 2 год, якщо до розчину докладено напругу 2 В, а його опір 5 Ом (к = 1,118 · IO 6 кг/Кл).

Головне в цьому параграфі_
Речовини, розчини і розплави яких проводять електричний струм називають електролітами.
Електролітична дисоціація — процес розпаду молекул на йони. Паралельно з електролітичною дисоціацією відбувається зворотний процес з'єднання йонів у нейтральні молекули — рекомбінація.
Провідність розчинів і розплавів електролітів зумовлена рухом йонів, її називають йонною.
Процес виділення речовини на електродах під час проходження електричного струму через електроліт називають електролізом.
Закон Фарадея: маса речовини, яка виділилася на електроді під час електролізу, прямо пропорційна силі струму та часу проходження струму через електроліт: m= kq\т= kit.
Електрохімічний еквівалент кчисельно дорівнює масі речовини в кілограмах, яка виділяється під час проходження 1 Кл електрики.
Електроліз використовують в технологи рафінування металів — очищенні їх від домішок.
Покриття провідної поверхні шаром певного металу електролітичним способом називають гальваностегією.
Гальванопластика — отримання копії різних металевих предметів за допомогою електролізу.
Запитання для самоперевірки_
1. Що називають електролітами?
2. Поясніть механізм електролітичної дисоціації.
3. Поясніть механізм провідності розчинів і розплавів електролітів.
4. Що називають електролізом?
5. Від чого залежить маса речовини, яка виділяється на електроді під час електролізу?
6. У чому полягає фізичний зміст електрохімічного еквіваленту речовини?
7. У чому полягає процес рафінування металів?
8. У чому полягає суть гальваностегії?
9. Поясніть, які фізичні явища відбуваються в процесі гальванопластики.
Вправа до § 13
1п. Поясніть, як залежить опір електроліту від температури.
2п. Поясніть, під час використання яких електродів (мідніх чи вугільних) процес електролізу триватиме довше.
2с. Визначте масу міді, що виділилася під час електролізу з розчину мідного купоросу, якщо через розчин пройшов електричний заряд 2500 Кл.
Зд. Визначте на скільки змінилася маса катода під час проведення електролізу солі заліза впродовж 1 год 45 хв при силі струму 2,5 А, якщо електрохімічний еквівалент заліза 0,19 мг/Кл.
4д. Визначте час електролізу, за який на катоді виділиться 20 г натрію при силі струму 12 А. Електрохімічний еквівалент натрію 0,24 мг/Кл.
5д. За 10 хв у гальванічній ванні виділилося 0,67 г срібла. Амперметр, увімкнений послідовно з ванною, показував 0,9 А. Встановіть, чи правильні покази амперметра.
6в. Визначте товщину шару нікелю, що осяде на деталі площею 0,2 м2, якщо процес нікелювання тривав 2 год при силі струму 25 А. Електрохімічний еквівалент нікелю к = 3 · 10 7 кг/Кп, а його густина 8,9 · 103 кг/м3.
Це матеріал з Підручника Фізика 8 Клас Головко
Автор: evg от 7-08-2016, 14:39, Переглядів: 3743