§ 50. Природа електричного струму в розчинах і розплавах електролітів. Закон Фарадея
Розглянемо хімічну дію струму. Пропускаючи струм через розчин мідного купоросу, ми спостерігали за виділенням міді на вугільному катоді. Спочатку вугільний катод покривається ледве помітним шаром міді, потім у міру пропускання струму, шар міді на катоді збільшується.
Явище виділення речовини на електродах при проходженні струму через електроліт називається електролізом.
Пропускаючи через різні електроліти різні струми і старанно вимірюючи масу речовини, яка виділяється на електродах з кожного електроліту, англійський фізик Фарадей у 1833—1834 рр. відкрив закон електролізу.
Цей закон формулюється так: маса речовини, яка
виділяється під час електролізу на кожному з електродів, прямо пропорційна величині заряду, що пройшов через електроліт:
т = kq,
де т — маса виділеної речовини, q — заряд. Коефіцієнт k називається електрохімічним еквівалентом речовини, він характеризує речовини, що виділяються на електродах під час електролізу.
Якщо у формулі т = kq прийняти q — 1 Кл, тоді електрохімічний еквівалент речовини чисельно дорівнює масі речовини, яка виділилась з електроліту під час проходження чеоез нього заряду в один кулон:
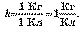
Підставивши у формулу q = It, дістанемо:
т = kit.
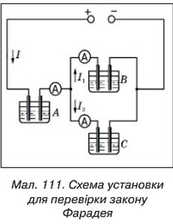
Закон Фарадея можна перевірити на досліді так. Пропустимо струм через електроліти А, В, C (мал. 111). Якщо всі ці електроліти однакові, то маси виділеної речовини на електродах в посудинах А, В, C будуть ВІДНОСИТИСЯ ЯК СИЛИ струмів І, 11 і I2. При цьому маса речовини, виділеної в посудині А, дорівнюватиме сумі мас речовин, виділених в посудинах В, С, оскільки сила струму I = I1 +I2-
Таблиця 13.
Електрохімічні еквіваленти деяких речовин
Явище виділення речовини на електродах під час проходження електричного струму через електроліт називають електролізом. Маса речовини, що виділяється на електродах під час проходження електричного струму через електроліт, прямо пропорційна кількості заряду, що пройшов через електроліт, і залежить від роду речовин.
1. Яке явище називається електролізом? 2. В чому полягає закон електролізу? 3. Як закон електролізу виразити формулами? 4. Що таке електрохімічний еквівалент?
? 1. Як пояснити, що розчин, який містить йони, залишається електронейтральним? 2. Чому всі різнойменні йони в електроліті не об’єднуються під дією взаємного притягання в нейтральні молекули? 3. До
електродів, що опущені в розчин мідного купоросу, підведена напруга 2 В. Опір розчину 0,3 Ом. Скільки міді виділиться на катоді за 10 хв? 4. За 10 хв на електроді, опущеному в електроліт, виділилося 0,67 г срібла. Амперметр показав силу струму в колі 0,9 А. Чи правильні покази амперметра? 5. Як при поясненні явища електролізу використати загальні закони природи?
Приклади застосування електролізу у промисловості та техніці. Сучасні технології в електротехніці неможливі без використання чистих матеріалів. Зокрема чиста мідь — незамінний матеріал для виготовлення провідників через свою низьку питому теплоємність.
Електроліз широко застосовується для добування чистих металів, наприклад, міді. Очищення речовин від домішок називається рафінуванням.
Рафінування міді відбувається на спеціальних заводах. Бетонні чани наповнюють розчином мідного купоросу. У кожний із них опускають кілька з’єднаних паралельно мідних катодів у вигляді з тонких пластинок хімічно чистої міді, між ними розташовують паралельно з’єднані аноди — товсті пластини з неочищеної міді. Завдяки електролізу на
катоді відкладається чиста мідь, що виділяється із мідного купоросу. Анодні пластини стають тоншими. Сторонні домішки, присутні у матеріалі аноду, випадають в осад. Коли катодна пластина набуває необхідних розмірів, її виймають з розчину і замість неї ставлять нову тонку мідну пластинку. Замість відпрацьованої анодної пластинки також ставлять нову.
Електроліз застосовується також для добування алюмінію з алюміній оксиду (глинозему). У 1881 р. алюміній було добуто лабораторним способом, його вартість наближалася до вартості золота. Промислове застосування електролізу для добування алюмінію стало можливим завдяки здешевленню електричної енергії.
Для електролізу алюмінію з глинозему застосовують електролізні ванни. Електролітом є розчин глинозему в розплавленому кріоліті (Na3AlF6). У спеціальні тиглі всипають зазначені вище речовини. Сам тигель використовується у якості катода. Анодом є вугільні стрижні, опущені в тигель. Струм іде через розплавлену масу, і на катоді (дно і стінки тигля) починає виділятися чистий алюміній в рідкому вигляді.
Розплавлений алюміній важчий за руду. Тому він опускається на дно, звідки його через спеціальний отвір відводять для виливання у форми. Крім алюмінію, за допомогою електролізу добувають натрій, магній, кальцій та інші речовини.
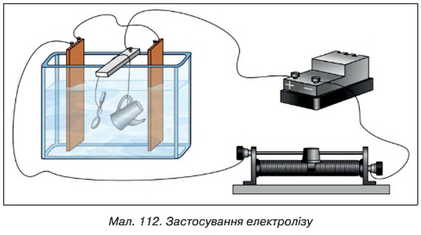
Електричний спосіб покриття предметів металами, що не окиснюються, має назву гальваностегії (мал. 112).
Поверхню металевих предметів, які легко піддаються окисненню, часто покривають металами, що окиснюються значно повільніше: нікелем, сріблом, цинком і ін. У побуті вам, напевно, постійно
доводиться мати справу з нікельованими предметами: чайниками, ковзанами, ножами, виделки і т. д. Широкого використання набули також посріблені предмети.
За допомогою електролізу створюють металеві рельєфні копії рельєфних предметів. Наприклад, потрібно зняти копію з рельєфного малюнка, виконаного на дерев’яній дошці шляхом різьби. Для цього рельєфний малюнок вкривають тонким шаром графіту для набуття рельєфною поверхнею провідності електричного струму. Підготовлену дошку опускають у розчин мідного купоросу й використовують як катод у процесі електролізу. У якості анода у електроліт поміщають мідну пластину.
Протягом процесу електролізу мідь виділяється на поверхні рельєфного малюнка. Коли шар міді стане досить товстим, його відділяють від дошки. Таким чином отримують мідний лист із зворотним зображенням рельєфного малюнка, який відрізняється від оригінала тим, що опуклості стають заглибинами і навпаки.
Електролітичний спосіб отримання копії предмета називається гальванопластикою. Для отримання точної копії оригінала процес гальванопластики повторюють.
Гальванопластика застосовується для виготовлення копій з барельєфів, статуй тощо. У поліграфічній промисловості гальванопластика застосовується для виготовлення гальванопластичних копій з цинкографічних кліше для тиснення і нанесення металевої фольги різні поліграфічні матеріали.
Електроліз широко застосовується для добування хімічно чистих металів, для електролітичного покриття предметів шаром металу.
Це матеріал з підручника Фізика 8 клас Гуз
Автор: evg от 7-08-2016, 14:13, Переглядів: 1987