Добування кисню у промисловості та лабораторії. Реакція розкладу. Поняття про каталізатор
Подібно до того як з води і повітря можна добути кисень, так само з багатьох сполук, які містять Оксиген, досить просто отримати чистий кисень.
За Д.І. Менделєєвим. «Основи хімії»
Опрацювавши матеріал параграфа, ви зможете:
• наводити приклади реакцій розкладу і пояснювати їхню суть;
• складати рівняння реакції добування кисню з гідроген пероксиду;
• визначати кисень дослідним шляхом;
• оцінювати значення каталізаторів.
Добування кисню у промисловості. Сировиною для промислового добування кисню є повітря - невичерпний природний ресурс. Спосіб добування ґрунтується на розділенні за низької температури однорідної суміші газів з різними температурами кипіння. За допомогою спеціальної апаратури повітря зріджують, а потім переганяють (дистилюють). Температура кипіння кисню вища за температуру кипіння азоту. Тому з рідини першим випаровується азот, а в залишку накопичується кисень. Зріджений кисень зберігають у термоізольованих металевих посудинах (пригадайте, ім’ям якого науковця їх названо) - кисневих танках.
Також кисень можна виокремити з повітря в інший спосіб. Потік стисненого повітря спрямовують на шар мікропористого матеріалу. Розмір пор у ньому порівняний з розміром молекул газів повітря. Матеріал поглинає азот та інші гази й не вбирає кисень. Його потік виходить з установки для розділення повітря і використовується для виробничих потреб.
У лабораторних умовах кисень добувають розкладанням деяких окси-геновмісних речовин, наприклад, гідроген пероксиду. Ця речовина добре відома вам з повсякденного життя: її 3 %-й водний розчин має бути в кожній аптечці першої допомоги.
Гідроген пероксид малостійкий, під час зберігання повільно розкладається на воду і кисень:
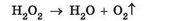
Перетворіть схему реакції розкладання гідроген пероксиду на хімічне рівняння.
Нагрівання (рис. 20.1) й освітлення пришвидшують цей процес.
Реакцією розкладу називають хімічну реакцію за участю одного реагенту з утворенням кількох продуктів реакції.
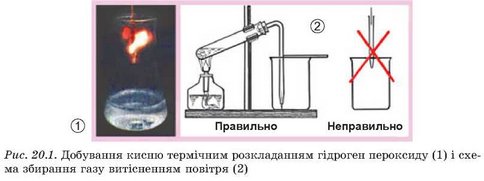
Пригадайте фізичні властивості кисню (див. § 17) і порівняйте його густину з густиною повітря. Поясніть, чому кисень збирають до посудини, розташованої отвором догори. Для чого її частково накрили скельцем? Чому газовідвідну трубку потрібно занурити в посудину до дна?
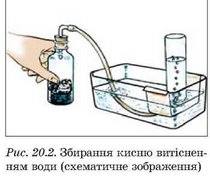
Кисень можна зібрати не лише витісненням повітря, а й витісненням води (рис. 20.2). Для збирання газу потрібен кристалізатор, на третину заповнений водою. Посудину-приймач наповнюють доверху водою, закривають отвір і опускають у кристалізатор. Коли отвір посудини опиниться під водою, його відкривають і вводять у посудину газовідвідну трубку. Після того як усю воду буде витіснено з посудини газом, отвір закривають під водою і виймають посудину з кристалізатора.
Яка фізична властивість кисню робить можливим його збирання витісненням води?

Як виявити кисень? Тліюча скіпка яскраво спалахує біля отвору газовідвідної трубки приладу або внаслідок унесення в посудину з киснем (рис. 20.3).
Вам доводилося спостерігати, що, потрапивши на подряпину або ранку, гідроген пероксид розкладається набагато інтенсивніше (сильно пузириться, «сичить»). Це відбувається тому, що кров містить речовини, які пришвидшують розкладання гідроген пероксиду, - ферменти, або біологічні каталізатори.
Рис. 20.3.Про що свідчить спалахування тліючої скіпки в посудині з нагрітим гідроген пероксидом?
Каталізатори — речовини, які пришвидшують хімічні реакції, але не входять до складу їхніх продуктів.
Ферменти — біологічні каталізатори — пришвидшують хімічні реакції в живих організмах.
Розкладання гідроген пероксиду може пришвидшувати чимало речовин. Поміж них - манган(ІУ) оксид, хімічна формула якого Мп02. Щіпка цієї сполуки пришвидшує розкладання все нових і нових порцій гідроген пероксиду (рис. 20.4). Сам манган(ІУ) оксид бере участь у реакції, однак унаслідок її перебігу не витрачається і не входить до складу її продуктів.

Каталізатори відіграють важливу роль у житті людини. Ферменти беруть участь у регуляції б іохімічних процесів.
З давніх-давен і дотепер ферментативні процеси застосовують у хлібопеченні, сироварінні (рис. 20.5), виноробстві, пивоварінні, чинбарстві тощо.
І нині ферменти застосовують у промисловості для переробки цукру, одержання синтетичних антибіотиків і білків. У мийні засоби добавляють ферменти, які пришвидшують розщеплення забруднень білкової природи.
Істотна риса сучасної практичної хімії - здійснення процесів з використанням каталізаторів, наприклад перетворення олії на маргарин.
Каталітичні методи очищення газуватих відходів промислових підприємств застосовують для видалення різноманітних токсичних сполук. Також каталізатори потрібні для очищення автомобільних вихлопних газів (рис. 20.6).

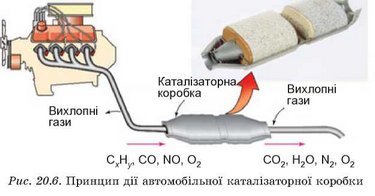
На які речовини перетворюються складники автомобільних вихлопних газів після каталітичного очищення?
Про хімічні реакції, на яких ґрунтуються ці перетворення, ви дізнаєтеся з наступного параграфа.
ПРО ГОЛОВНЕ
• Сировиною для промислового добування кисню є повітря.
• У лабораторних умовах кисень добувають розкладанням деяких окси-геновмісних речовин, наприклад гідроген пероксиду:
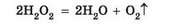
Реакцією розкладу називають хімічну реакцію за участю одного реагенту з утворенням кількох продуктів реакції.
Кисень можна зібрати витісненням повітря в посудину, розташовану отвором догори, тому що його густина більша за густину повітря, і витісненням води, тому що він - малорозчинний у воді газ.
Кисень виявляють за допомогою тліючої скіпки, що яскраво спалахує в ньому.
Каталізатори - речовини, які пришвидшують хімічні реакції, але не входять до складу їхніх продуктів. Ферменти - біологічні каталізатори. Каталізатори відіграють важливу роль у житті людини.
Перевірте себе
1. Із чого добувають кисень у промисловості?
2. Як добувають кисень у лабораторних умовах?
3. Що таке реакція розкладу?
4. Якими способами можна зібрати кисень у посудину?
5. Як виявляють кисень?
6. Що таке каталізатор?
Застосуйте свої знання й уміння
7. Чому як сировину для промислового добування кисню використовують повітря?
8. Чому зріджений кисень зберігають у термоізольованих посудинах?
9. Чому розчин гідроген пероксиду потрібно зберігати у нещільно закоркованих флаконах з темного скла, у прохолодному місці?
10. Голландський природодослідник Ян Баптист ван Гельмонт (1579-1644) вивчав «летючі речовини» й увів у науку термін «гази». Він зауважував, що їх «не можна зібрати ні в яку посудину й зробити видимим тілом». Чи правильні його твердження?
11. Раніше на підводних човнах для добування кисню застосовували натрій пероксид: Ыа202 + С02 ^ Ыа2С03 + 02Т. Нині використовують реакцію розкладання води електричним струмом:

Перетворіть схеми цих реакцій на хімічні рівняння.
Яку істотну перевагу має спосіб очищення повітря з використанням натрій пероксиду?
12. Найвизначніша наукова праця Карла Вільгельма Шеєле - «Хімічний трактат про повітря й вогонь» (1777). У ній описано результати численних експериментів ученого з дослідження газів і процесів горіння (1768-1773). К. Шеєле незалежно від Дж. Прістлі й А. Лавуазьє за два роки до них добув кисень багатьма способами й докладно описав його властивості. Перетворіть схеми пророблених ним реакцій на хімічні рівняння. Визначте, чи всі ці реакції є реакціями розкладу. Класифікуйте реагенти та продукти за складом.
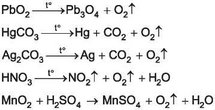
13. Проаналізуйте відомості про способи добування кисню в промисловості й лабораторії, складіть узагальнювальну схему.
14. Датчанин Корнеліус ван Дреббель (1572-1633) у 1620 р. сконструював підводний човен. За свідченнями сучасників, винахідник використав для «відновлення» повітря в підводному човні газ, який одержував нагріванням селітри. Відтворіть хімічне рівняння розкладання селітри за наведеним фрагментом: 2КЫ03 = 2КЫ02 + ...
15. Англійський священик Джозеф Прістлі (1733-1804) не мав спеціальної хімічної освіти. Проте саме він удосконалив пневматичну ванну (рис. 20.2), використавши замість води ртуть. Це дозволило ефективно збирати й аналізувати речовини, які досі вважали невловимими - гази. 1 серпня 1774 р., нагріваючи за допомогою лінзи червоний меркурій(ІІ) оксид, він добув і зібрав газ. У ньому добре горіла свічка, а тліюча скіпка яскраво спалахувала. Відтворіть хімічне рівняння розкладання меркурій(ІІ) оксиду за наведеним фрагментом: 2Нд0 = ...Нд + ...
16. Оцініть значення каталізаторів у житті людини.
Домашній експеримент
Дія гідроген пероксиду на сирі та відварені овочі, м’ясо
Мета: порівняти дію гідроген пероксиду на сирі та відварені овочі, м’ясо.
Помістіть у прозорі пластикові стаканчики невеликі шматочки сирих і відварених м’яса та овочів (картоплі, капусти, моркви тощо). Прилийте до них по столовій ложці 3 %-го розчину гідроген пероксиду (він має бути в кожній домашній аптечці).
Опишіть спостереження, ілюструйте їх фото- або відеоматеріалами. У висновку поясніть свої спостереження.
Дізнайтеся більше про добування кисню (с. 180).
ПРАКТИЧНА РОБОТА 4
Добування кисню з гідроген пероксиду, збирання, доведення його наявності
Запишіть у призначеному для цього зошиті дату, назву практичної роботи та її мету.
Пригадайте правила безпеки під час роботи в хімічному кабінеті і неухильно їх дотримуйтеся!
Уважно розгляньте видані вам для роботи лабораторне обладнання, хімічний посуд і речовини. Запишіть у зошиті їхні назви.
Дотримуючись вивчених правил безпеки, виконайте досліди за вказівкою вчителя.
Завдання. Одним зі способів, описаних в інструкціях, добудьте і зберіть кисень та доведіть його наявність. Після виконання кожного досліду відразу ж записуйте послідовність дій, спостереження й висновки з них.
Інструкція
Зберіть прилад для добування кисню (див. рис. 20.1 або 20.2) і перевірте його на герметичність. Для цього занурте кінець газовідвідної трубки в посудину з водою, а пробірку на декілька секунд затисніть у долоні.
Нагріваючись від тепла руки, повітря в пробірці розшириться і бульбашками виходитиме з газовідвідної трубки (рис. 1).
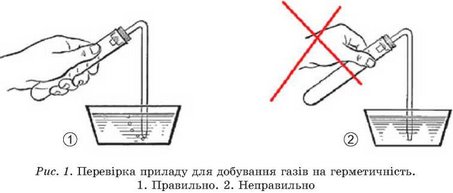
Поясніть, чому потрібно перевіряти прилад для добування газів так, як зображено на рисунку 1,1, а не на рисунку 1,2.
Якщо бульбашок немає, то це означає, що прилад зібрано негерметично і для газу є інший вихід, окрім газовідвідної трубки. Потрібно розібрати прилад і зібрати так, щоб сполучення були герметичними.
Дослід 1. Добування кисню термічним розкладанням гідроген пероксиду, збирання його витісненням повітря (або води)
У пробірку помістіть трохи річкового піску чи порцелянових черепків - вони забезпечать рівномірне кипіння рідини. Добавте 3%-й водний розчин гідроген пероксиду об’ємом 5 см3 і закрийте пробірку пробкою з газовідвідною трубкою. Обережно прогрійте всю пробірку з гідроген пероксидом, а потім нагрівайте те місце, де міститься речовина.
Зберіть кисень витісненням повітря у пробірку, розташовану отвором угору. Повноту заповнення киснем пробірки визначте, підносячи до її отвору тліючу скіпку.
Занурте у пробірку із зібраним киснем тліючу скіпку.
Опишіть хід роботи і спостереження. Обґрунтуйте, чому кисень можна зібрати витісненням повітря у пробірку, розміщену отвором вгору. Запишіть рівняння реакції розкладання гідроген пероксиду, зазначте умови її перебігу.
Дослід 2. Добування кисню каталітичним розкладанням гідроген пероксиду, збирання його витісненням повітря (або води)
У пробірку помістіть трохи манган(ІУ) оксиду. Добавте розчин гідроген пероксиду об’ємом 5 см3 і хутко закрийте пробірку пробкою з газовідвідною трубкою.
Збирайте кисень витісненням повітря у пробірку, розташовану отвором угору. Повноту заповнення киснем пробірки визначте, підносячи до її отвору тліючу скіпку (збирайте кисень витісненням води у пробірку так, як це зображено на рисунку 20.2).
Занурте у пробірку із зібраним киснем тліючу скіпку.
Опишіть хід роботи і спостереження. Обґрунтуйте, чому кисень можна зібрати витісненням повітря у пробірку, розміщену отвором угору. Запишіть рівняння реакції розкладання гідроген пероксиду, зазначте умови її перебігу. Поясніть роль манган(ІУ) оксиду в цій реакції.
Звіт про виконання роботи оформіть у довільній формі, наприклад як таблицю. Замість словесного опису можете зробити рисунки з пояснювальними написами, схеми тощо.
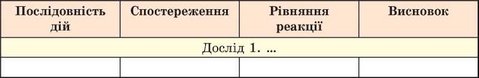
Проаналізуйте результати, досягнуті під час виконання роботи. Порівняйте їх з поставленою метою. Які з набутих знань і умінь ви вважаєте для себе найважливішими?
Дізнайтеся більше про добування кисню з гідроген пероксиду (с.180).
Це матеріал з підручника Хімія 7 клас Лашевська
Автор: admin от 12-02-2017, 11:42, Переглядів: 35569