Добування і зберігання кисню
Розкладання оксидів
Методи добування кисню можна поділити на промислові та лабораторні. У лабораторії кисень зручніше добувати з тих його сполук, які при нагріванні легко розкладаються з виділенням кисню. Найчастіше для цього використовують калій перманганат KMnO4, калій хлорат KCЮ3 (бертолетову сіль), калій нітрат KNO3 (індійську селітру), гідроген пероксид Н2О2.
Уперше кисень був добутий нагріванням меркурій(П) оксиду HgO сфокусованими сонячними променями. При цьому утворюється рідка ртуть і газуватий кисень (мал. 90):
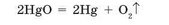
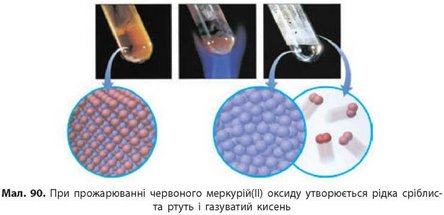
У такий спосіб можуть розкладатися сполуки й інших неактивних металічних елементів з Оксигеном.
Але зазвичай такі реакції відбуваються при дуже високих температурах, тому їх використовувати для добування кисню в лабораторії не дуже зручно.
Розкладання бертолетової солі. Каталізатори
Покладемо в чисту суху пробірку декілька кристалів бертолетової солі та нагріватимемо її в полум’ї спиртівки. Спочатку сіль починає плавитися (357 °С), а потім розплав закипає (400 °С) — починається розкладання з виділенням безбарвного газу за рівнянням:
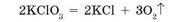
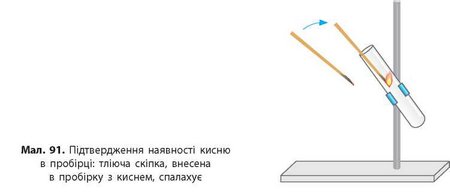
Щоб довести, що газ, який виділяється, є киснем, у пробірку вносимо тліючу скіпку (мал. 91). Скіпка яскраво спалахує. Це означає, що добутий газ — кисень, оскільки він підтримує горіння.
Щоб прискорити реакцію, до бертолетової солі можна додати невелику кількість порошку манган(ГУ') оксиду Мп02. За його наявності кисень починає виділятися при значно нижчій температурі (200 °С), навіть нижчій за температуру плавлення. Манган(ГУ) оксид у цій реакції не витрачається, він тільки прискорює її. Такі речовини називають каталізаторами, а пришвидшення реакції під дією каталізатора — каталізом.
Каталізатори — це речовини, які змінюють швидкість хімічної реакції, проте самі в ній не витрачаються.
Здатність певних речовин прискорювати хімічні реакції відома вже понад 200 років, але перші класичні пояснення цього явища, а також наведене визначення каталізаторів було введено видатним хіміком В. Оствальдом.

Видатний німецький фізико-хімік, лауреат Нобелівської премії 1909 року. Народився в Ризі, де навчався та в 28 років почав працювати професором. У віці 35 років переїхав до Лейпцига, де очолив Фізико-хі-мічний інститут. Вільгельм Оствальд вивчав закони хімічної рівноваги, електричні властивості розчинів, відкрив закон розбавлення, що був названий його ім'ям, розробив основи теорії кислотно-основного каталізу, багато займався історією хімії.
Заснував першу в світі кафедру фізичної хімії і перший фізико-хімічний журнал. Свого часу активно підтримав теорію Арреніуса, чим сприяв її визнанню іншими хіміками.
Розкладання калій перманганату
Кисень у лабораторії зручно добувати з калій перманганату KMnO4. Калій перманганат являє собою чорно-фіолетові кристали зі специфічним блиском (мал. 92). Невелику кількість порошку калій перманганату помістимо в пробірку. Щоб уникнути розкидання порошку, в пробірку слід помістити ватний тампон (мал. 93).
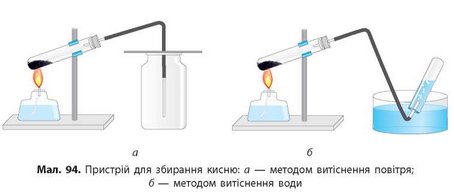
Для того щоб почалася реакція, пробірку необхідно нагріти приблизно до 230 °С. Порошок поступово нагрівається і починає розтріскуватися — відбувається реакція:
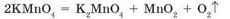
Якщо до пробірки приєднати газовідвідну трубку, то кисень, що виділяється, можна зібрати в яку-небудь посудину.

Як можна зібрати добутий кисень?
Кисень важчий за повітря і малорозчинний у воді, тому його можна збирати двома способами: витісненням повітря і витісненням води. У першому випадку (мал. 94а) кисень, який надходить у посудину скляною трубкою, поступово витісняє повітря. Щоб уникнути перемішування кисню з атмосферним повітрям, отвір посудини нещільно закривають шматком вати або аркушем фільтрувального паперу. Щоб переконатися, що посудина заповнилася киснем, до її отвору підносять тліючу скіпку. Якщо посудина заповнена, то скіпка спалахує біля отвору.
У разі збирання кисню над водою (мал. 946) газ, що виділяється, поступово витісняє воду із циліндра, заздалегідь заповненого водою. Коли газ повністю витіснить воду із циліндра, його отвір закривають склом і тільки потім виймають із води та перевертають.
Добування кисню з гідроген пероксиду
Часто для добування кисню в лабораторії використовують гідроген пероксид Н2О2. Гідроген пероксид за звичайних умов розкладається, але дуже повільно, навіть якщо його підігріти на пальнику. Але якщо в розчин гідроген пероксиду внести дрібку манган(ГУ) оксиду, то рідина дуже спінюється, майже «закипає» — це виділяється кисень:
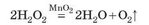
Після закінчення реакції в пробірці залишається суміш води та манган(^) оксиду. Цю суміш легко розділити фільтруванням. У цій реакції манган(^) оксид бере участь як каталізатор, але не реагує з гідроген пероксидом. У цьому легко впевнитися, якщо відфільтрований манган(^) оксид знову додати до гідроген пероксиду для розкладу його нової порції.
Оскільки каталізатори в процесі хімічної реакції не витрачаються, то їх додають до реагентів у дуже малій кількості. Існує навіть вираз «додати реагент у каталітичній кількості», що означає «дуже мало».
Реакції розкладу
Якщо уважно проаналізувати наведені рівняння реакцій добування кисню, то можна помітити спільну ознаку: у лівій частині цих рівнянь написана формула однієї речовини, а в правій — декількох. Такі реакції називаються реакціями розкладу.
Реакції, у яких з однієї складної речовини утворюється декілька інших речовин, називаються реакціями розкладу.
У загальному вигляді рівняння реакції розкладу можна записати в такий спосіб:
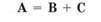
Добування кисню в промисловості. Зберігання кисню
Наведені вище методи добування кисню можуть бути застосовані тільки в лабораторних умовах. Для промислового добування великих обсягів кисню вони не використовуються через високу вартість початкових речовин. Великі кількості кисню добувають із рідкого повітря розділенням (ректифікацією). Спочатку повітря охолоджують до -200 °С, а потім поступово нагрівають. При -196 °С азот випаровується, а рідкий кисень залишається. Цей метод не можна назвати хімічним, оскільки кисень просто відокремлюється із суміші газів — повітря.
Добутий рідкий кисень зберігають у спеціальних балонах — посудинах Дьюара (мал. 95), які за будовою нагадують звичайний термос. Посудина Дьюара має дві стінки, з простору між якими відкачане повітря. Завдяки цьому посудина майже не пропускає

теплоту, і в ній тривалий час при низькій температурі може зберігатися зріджений газ.
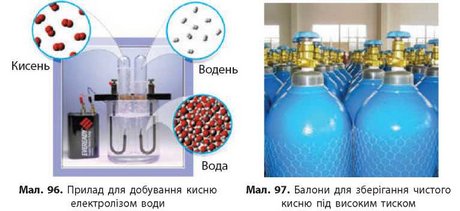
Часто в промисловості кисень добувають із води. Під дією електричного струму вода розкладається на дві прості речовини — кисень і водень. Цей процес називають електролізом (мал. 96).

Електроліз води відбувається досить повільно і потребує значних витрат електрики, але добутий кисень є досить чистим, тому в деяких випадках цей метод є доцільним.
Добутий газуватий кисень зберігають у спеціальних сталевих балонах під високим тиском, щоб він займав менше місця. Балони з киснем фарбують у синій колір, щоб не сплутати їх з балонами, наповненими іншими газами (мал. 97). Вентилі таких балонів
у жодному разі не можна змащувати машинними мастилами, оскільки навіть залишки мастила в потоці чистого кисню спричинять сильний вибух.
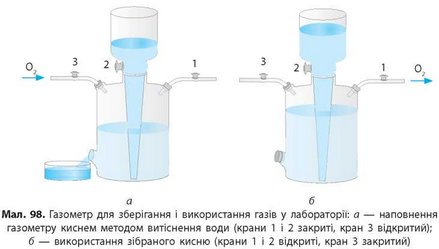
Для зберігання кисню і зручного користування ним у лабораторії використовують інший пристрій — газометр (мал. 98). Це великий скляний балон із великою лійкою, заповненою водою. Спочатку газометр заповнюють киснем методом витіснення води (мал. 98а). Коли газометр заповнений, відкривають кран 2 і вода з лійки витісняє зібраний газ через кран 1 (мал. 986).
Висновки:
1. У лабораторії кисень добувають розкладанням складних речовин: бертолетової солі, калій перманганату або гідроген пероксиду. Добутий кисень можна виявити, використовуючи тліючу скіпку, а збирають його методом витіснення води або повітря.
2. Реакції добування кисню є реакціями розкладу, у яких з однієї речовини утворюється декілька. Часто вони відбуваються за участю каталізаторів — речовин, що прискорюють хімічні реакції, але самі при цьому не витрачаються.
3. У промисловості кисень добувають або розділенням (ректифікацією) повітря, або реакцією розкладу води електролізом.
Контрольні запитання
1. Які умови перебігу реакцій є загальними для описаних лабораторних методів добування кисню?
2. Виберіть речовини, розкладанням яких можна добути кисень: а) калій перманганат KMnO4; б) вуглекислий газ ТО.; в) вода H2O; г) манган(^) оксид Мп02.
3. Які реакції називають реакціями розкладу?
4. Як кисень добувають у промисловості?
5. Які речовини називаються каталізаторами? Чому каталізатори додають у невеликих кількостях?
6. Чим принципово відрізняються лабораторні та промислові способи добування кисню?
7. У який спосіб можна довести наявність чистого кисню в посудині? На якій властивості кисню він ґрунтується?
8. Наведіть способи збирання кисню. На яких властивостях кисню вони ґрунтуються?
9. У яких посудинах зберігають газуватий і рідкий кисень?
10. Як відрізнити балон, у якому зберігається кисень? Чому не можна змащувати вентилі кисневих балонів мастилом?
Завдання для засвоєння матеріалу
1. Назвіть лабораторні методи добування кисню. Напишіть відповідні рівняння реакцій.
2. Складіть формули сполук Оксигену з Гідрогеном, Калієм, Магнієм, Алюмінієм, Карбоном(^), Фосфором^) і Сульфуром^І).
3. У якій сполуці вміст Оксигену більший (за масовою часткою) — у калій перманганаті чи бертолетовій солі?
4. Як зміниться стан терезів, якщо в порожню склянку, яка врівноважена на терезах, через трубочку додати кисень?
5. У хімічну склянку налили розчин гідроген пероксиду масою 400 г і додали дрібку манган(^) оксиду. Після завершення виділення бульбашок газу в склянці залишилася вода масою 375 г. Обчисліть масу виділеного кисню.
6. Для добування кисню у пробірку помістили калій перманганат масою 20 г. Після прожарювання у пробірці залишився твердий залишок масою 18 г. Обчисліть масу добутого кисню. Який об'єм займає цей кисень? (Для обчислення використовуйте дані з попереднього параграфа).
7*. Як ви вважаєте, на чому ґрунтується дія каталізаторів? Чому каталізатори не витрачаються в реакціях?
8. Поясніть, чому посудину Дьюара, заповнену зрідженим газом, не можна щільно закривати накривкою.
ПРАКТИЧНА РОБОТА № 4
Добування кисню з гідроген пероксиду, збирання, доведення його наявності
Обладнання: лабораторний штатив, пробірки, спиртівка, кристалізатор або велика посудина, заповнена водою, колба, кутова скляна трубка, гумові корки (з отвором і без), піпетка. Реактиви: гідроген пероксид, манган(ГУ) оксид, скіпка.
Правила безпеки:
• при проведенні дослідів використовуйте невеликі кількості реактивів;
• остерігайтеся потрапляння реактивів на одяг, шкіру, в очі;
• пам’ятайте, що холодні і гарячі предмети на зовнішній вигляд однакові, нагрівання здійснюйте лише з використанням спеціальних тримачів;
• обережно поводьтеся при закріпленні пробірок у штативі.
1. Добування кисню розкладом гідроген пероксиду
У велику пробірку (або плоскодонну колбу) внесіть дрібку каталізатора — манган(ГУ) оксиду. Пробірку закрийте корком з двома отворами. В один отвір необхідно вставити газовідвідну трубку, а в інший — піпетку з розчином гідроген пероксиду.
Піпеткою краплями додавайте гідроген пероксид і спостерігайте виділення кисню.
2. Збирання кисню методом витіснення повітря
До отвору газовідвідної трубки піднесіть порожню суху пробірку і зберіть кисень у пробірку. Пробірку для збирання кисню можна прикрити аркушем картону, у якому прорізаний отвір для газовідвідної трубки.
3. Збирання кисню методом витіснення води
Для добування кисню скористайтеся тим самим приладом, який був зібраний згідно з рекомендаціями п.1. Для збирання кисню методом витіснення води занурте пробірку в кристалізатор з водою, наповніть її водою та обережно переверніть пробірку отвором донизу, щоб отвір лишався у воді (див. мал. 94б на с. 125). Піднесіть кінець газовідвідної трубки приладу до отвору пробірки у воді та наповніть пробірку киснем.
4. Доведення наявності кисню
Підготуйте тліючу скіпку: спочатку запаліть, а потім загасіть її. Доки скіпка тліє, внесіть її в пробірку із зібраним киснем.
У зошиті для практичних робіт опишіть свої спостереження, складіть рівняння реакцій розкладу гідроген пероксиду і горіння вугілля (тліючої скіпки). Замалюйте прилад для добування кисню.
5. Формулювання висновків
За результатами практичної роботи зробіть висновки.
При формулюванні висновків використовуйте відповіді на такі запитання:
1. Як називають метод збирання газів, що ви використали в цій роботі?
2. У який спосіб можна довести, що пробірка повністю заповнена киснем?
3. Чому для добування кисню розкладом гідроген пероксиду краще використовувати колбу, а не пробірку? Яку роль виконує манган(ІУ) оксид у цьому методі?
4. Чи можна добути кисень розкладом гідроген пероксиду без манган(ІУ) оксиду?
• Гідроген пероксид у побуті називають перекис водню. Зазвичай він використовується у вигляді 3-5%-го водного розчину для дезінфекції подряпин і дрібних ран. Потрапивши на ранку, гідроген пероксид під дією каталізаторів, наявних у крові, починає виділяти кисень, який убиває бактерії, закупорює дрібні судини і зупиняє кровотечу. Також гідроген пероксид використовують у вигляді 30%-го водного розчину під назвою пергідроль.
• Калій перманганат KMnO4 дуже часто застосовується у побуті та медицині під назвою «марганцівка». Його використовують у вигляді дуже розбавленого розчину для промивання шлунка в разі отруєння.
Це матеріал з підручника Хімія 7 клас Григорович
Автор: admin от 18-01-2017, 22:43, Переглядів: 18664