§ 40. Способи добування оксидів
Пригадайте: простими речовинами називають речовини, що складаються з атомів тільки одного хімічного елемента, складними — речовини, що складаються з атомів декількох елементів; повторіть класифікацію оксидів.
Добування оксидів горінням простих речовин
Оксиди — це бінарні сполуки з Оксигеном, тому найпростіший спосіб добування оксидів — це взаємодія простих речовин з киснем:
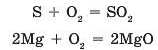
Майже всі прості речовини взаємодіють з киснем (окиснюються). Багато з них взаємодіють з киснем досить бурхливо навіть у повітрі, з виділенням великої кількості теплоти й світла, тобто горять (мал. 40.1).

Більшість металів взаємодіють з киснем досить повільно. Наприклад, мідь, залізо або ртуть необхідно прожарювати на повітрі тривалий час, щоб вони повністю прореагували. Із такими металами реакція відбувається набагато швидше, якщо її проводити не на повітрі, а використовувати чистий кисень:
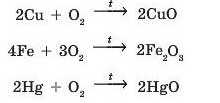
Деякі прості речовини взагалі не реагують з киснем. Серед металів — це платина та золото,
а серед неметалів — інертні гази (неон, аргон тощо) та галогени (хлор, бром, йод).
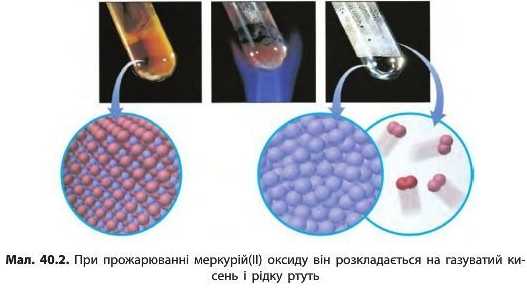
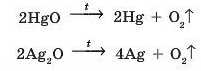
Якщо проста речовина дуже повільно взаємодіє з киснем або не взаємодіє зовсім, то відповідні оксиди дуже легко розкладаються при нагріванні (мал. 40.2):
Найактивніші метали, такі як натрій або калій, настільки активно взаємодіють з киснем, що зазвичай утворюють не оксиди, а пероксиди або надпероксиди: 2Na + O2 = Na2O2 (натрій пероксид)
K + O2 = KO2 (калій надпероксид)
Добування оксидів горінням складних речовин
Оксиди можна також добути взаємодією складних речовин з киснем. Значна кількість складних речовин може горіти в кисні на повітрі. Наприклад, унаслідок горіння метану CHj утворюються два оксиди: карбон(ІУ) оксид і гідроген оксид:
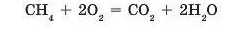
Гідроген сульфід (сірководень) H.,S згоряє в кисні також з утворенням двох оксидів: сульфур(ІУ) оксиду та гідроген оксиду:
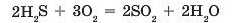
Для промисловості велике значення мають реакції згоряння сульфідів металічних елементів, оскільки в цих випадках утворюються два цінні оксиди — сульфур(ІУ) оксид, що використовують для добу BimH я сульфатної кислоти, та оксиди металічних елементів, з яких потім добувають метали:
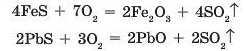
Елементи зі змінною валентністю здатні утворювати декілька оксидів. Оксид з нижчою валентністю елемента може взаємодіяти з киснем з утворенням оксиду з вищою валентністю. Наприклад, Фосфор при взаємодії з киснем може утворювати фосфор(ІІІ) оксид (нижчий оксид) і фосфор(У) оксид (вищий оксид). У цьому випадку нижчий оксид P.,Os взаємодіє з киснем з утворенням вищого оксиду Р.,0.:
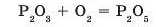
- ·» At At ЛМ
Аналогічно ферум(ІІ) оксид взаємодіє з киснем з утворенням ферум(ІІІ) оксиду:
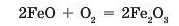
Дегідратація гідратів оксидів
Оксиди можна добувати також розкладанням (дегідратацією) нестійких гідратів оксидів: гідратів кислотних оксидів (кислот) та гідратів основних оксидів (гідроксидів):
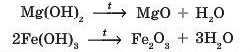
Такі реакції відбуваються при прожарюванні майже всіх гідроксидів, за винятком гідроксидів лужних елементів (Натрію та Калію). У такий спосіб можна добути оксиди навіть тих елементів, що у вигляді простої речовини не реагують з киснем, наприклад оксид Ауру му:
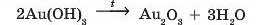
Дегідратацію оксигеновмісних кислот (гідратів кислотних оксидів) проводять нагріванням за наявності фосфор(У) оксиду (речовини, що активно поглинає воду):
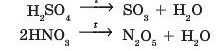
Такі кислоти, як карбонатна H2COs, сульфітна H2SO3 й силікатна H.,SiO3, легко перетворюються на оксиди навіть при незначному нагріванні:
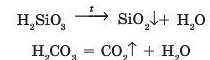
Термічне розкладання солей
Оксиди також утворюються при розкладанні деяких солей оксиге-повмісних кислот . При прожарюванні багатьох таких солей утворюються два оксиди: основний та кислотний (ангідрид відповідної кислоти):
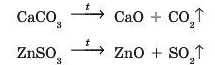
Такі реакції відбуваються лише за умови, що один з продуктів реакції (оксидів) є летким, наприклад: SO2, CO.,, SOij.
Солі, що утворені нелеткими оксидами, при прожарюванні не розкладаються, а лише плавляться.
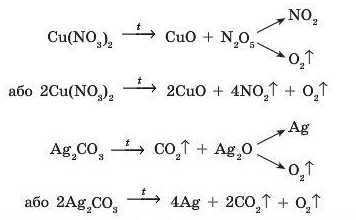
Якщо оксид, що утворюється під час розкладання, сам є термічно нестійким, то утворюються також продукти і його розпаду, наприклад:
Розкладанню при прожарюванні не піддаються солі Натрію та Калію. При нагріванні вони починають плавитися, а якщо і розкладаються, то за особливою схемою. Деякі з таких реакцій використовують у лабораторії для добування кисню:
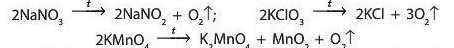
• Скло зі значним умістом плюмбум(ІІ) оксиду, що отримало назву кришталь, дуже схоже на алмаз. Із 1790 р. з кришталю почали виготовляти підроблене коштовне каміння. З безбарвного — алмази, із забарвленого золотом — яскраво-червоні рубіни, кобальт(ІІ) оксидом — сині сапфіри, а хром(ІІІ) оксидом — зелені ізумруди.
• Нітроген(І) оксид (N2O) використовують у лікарнях як наркоз під час операцій. Для нього характерний слабкий приємний запах і солодкуватий присмак. При вдиханні його в невеликих дозах настає наркотичне сп'яніння, для якого характерний веселий, навіть бешкетний, стан. Він спричиняє не-контрольовані судорожні рухи, що нагадують сміх, завдяки чому нітроген(І) оксид називають ще «звеселяючим газом».
• Основна сировина для добування алюмінію — алюміній оксид AI2Oj — у великій кількості міститься у звичайній глині. Алюміній має цінні властивості — легкий, міцний і, головне, дешевий. Сьогодні алюміній добувають дією електричного струму на алюміній оксид. Але до розробки електролітичного методу добування алюмінію було надмірно затратним. У 1855 р. 1 кг алюмінію коштував дорожче за золото або срібло. Завдяки цьому алюміній ще називали «сріблом з глини».
Висновки
1. Оксиди утворюються при взаємодії простих та складних речовин з киснем. Чим активніші речовини, тим легше вони вступають у реакцію з киснем.
2. Оксиди утворюються при розкладанні нестійких складних речовин: кислот, гідроксидів та солей. Розкладанню піддаються нерозчинні гідроксиди, нестійкі кислоти та солі, якщо при цьому утворюються леткі оксиди.
Контрольні запитання
1. Які прості речовини — метали й неметали — не взаємодіють з киснем? Наведіть приклади.
2. Опишіть, які гідроксиди, кислоти та солі здатні розкладатися з утворенням солей. Наведіть приклади.
Завдання для засвоєння матеріалу
1. Складіть рівняння реакції горіння вугілля, фосфору, бору, алюмінію, цинку. Назвіть продукти реакції. У якому випадку утворюються кислотні оксиди, а в якому — основні?
2. Манган(ІІ) карбонат розкладається при нагріванні на манган(ІІ) оксид і вуглекислий газ. Складіть рівняння реакції.
3. Складіть рівняння реакції добування нітроген(У) оксиду з нітратної кислоти.
4. Запропонуйте три способи добування вуглекислого газу.
5. При прожарюванні ферум(ІІІ) сульфату утворюються ферум(ІІІ) оксид і газ, що при взаємодії з водою утворює сульфатну кислоту. Складіть рівняння реакції.
6. Які речовини утворюються при нагріванні силікатної та карбонатної кислот? Складіть рівняння реакції.
7. Складіть рівняння реакцій розкладання солей: плюмбум(ІІ) карбонату, цинк нітрату, аргентум сульфіту, аргентум(І) нітрату. У яких випадках утворюються термічно нестійкі оксиди?
8. Доповніть схеми реакцій, назвіть продукти реакцій:
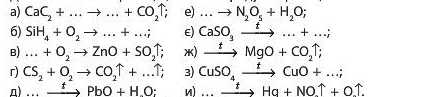
9. Складіть рівняння реакцій для здійснення перетворення:
a) Mg -» MgSO4 -» MgO -> MgCO1; б) Cu -> CuO -> Cu(NO1)j -> Cu(OH)j.
10. Обчисліть об'єм кисню (н. у.), необхідний для добування магній оксиду масою 240 г з магнію.
11. Обчисліть масу фосфору, що необхідно спалити для добування фосфор(У) оксиду масою 7,1 г.
12. Обчисліть об'єм газу (н. у.), що утворюється при розкладанні кальцій карбонату масою 250 г.
13*. Деякі промислові виробництва України використовують у різних технологічних процесах реакцію розкладу кальцій карбонату. У додаткових джерелах знайдіть інформацію про такі виробництва. У який спосіб запобігають надмірним викидам вуглекислого газу в атмосферу?
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 18:08, Переглядів: 4105