Відносна атомна маса. Відносна молекулярна маса
Пригадайте: визначити, яке тіло важче за інше, можна, порівнюючи маси цих тіл. Маса тіл вимірюється в кілограмах, грамах, тоннах та інших одиницях.
Відносна атомна маса
Однією з найважливіших характеристик хімічного елемента є його відносна атомна маса. Атоми — надзвичайно маленькі частинки. Їхня маса настільки мала, що виражати її в грамах або кілограмах дуже незручно. Маса навіть найважчих атомів становить близько 10-22 г, тобто 0,0000000000000000000001 г.
Зручніше виражати масу атомів, порівнюючи її з якою-небудь маленькою величиною.
Раніше масу атомів порівнювали з масою найлегшого атома — атома Гідрогену. У сучасній хімії маси атомів порівнюють з 1/12 маси атома Карбону. Цю одиницю вимірювання називають атомною одиницею маси, скорочено а. о. м. (мал. 61). Маса атома Карбону дорівнює 1,99 • 10-23 г, отже, атомна одиниця маси дорівнює:
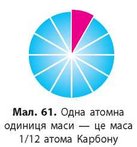

Знаючи значення а. о. м., можна порівняти з нею маси інших атомів і дізнатися, наскільки вони важчі за 1/12 маси атома Карбону. Масу атома, визначену порівнянням з атомною одиницею маси, називають відносною атомною масою і позначають Ar (індекс r — від англ. relative — відносний).
Відносна атомна маса — це відношення маси атома даного елемента до 1/12 маси атома Карбону.

Відносна атомна маса — це безрозмірна величина, оскільки вона є відношенням двох величин з однаковою розмірністю.
Відносні атомні маси легко обчислити, знаючи маси атомів у грамах. Наприклад, маса атома Сульфуру дорівнює 5,312 • 10-23 г, отже, його відносна атомна маса дорівнює (мал. 62):
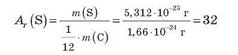
Відносна атомна маса Карбону, обчислена аналогічним чином, дорівнює 12. Відносна атомна маса показує, у скільки разів маса будь-якого атома більша за 1/12 маси атома Карбону. Наприклад, відносна атомна маса Оксигену АДО) = 16, отже, атом Оксигену в 16 разів важчий за 1/12 маси атома Карбону.
Сьогодні відносні атомні маси майже всіх елементів визначені з високою точністю і наведені в Періодичній системі хімічних елементів (мал. 57, с. 67). Зазвичай точні значення відносних атомних мас округляють до цілих чисел. Тільки значення відносної атомної маси для Хлору округляють із точністю до десятих: А (СІ) = 35,5.

Відносна молекулярна маса
Відносна маса застосовується не тільки для атомів, але й для молекул.
Відносна молекулярна маса Мг показує, у скільки разів маса молекули більша за 1/12 маси атома Карбону.
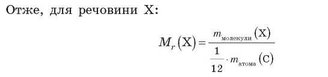
Відносна молекулярна маса дорівнює сумі відносних атомних мас усіх хімічних елементів, що містяться у складі молекули, з урахуванням числа атомів кожного елемента.
Для визначення відносної молекулярної маси речовини з формулою Е,^ необхідно відносні атомні маси елементів Е та D помножити на число їхніх атомів, відповідно на х та у, а потім підсумувати:
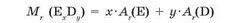
Наприклад, молекула води H2O складається з двох атомів Гідрогену й одного атома Оксигену. Отже, відносна молекулярна маса води дорівнює сумі двох відносних атомних мас Гідрогену й однієї відносної атомної маси Оксигену:
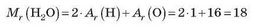
Аналогічно можна обчислити відносну молекулярну масу будь-якої речовини, якщо відома її хімічна формула. Наприклад, обчислимо відносні молекулярні маси азоту N і вуглекислого газу ТО2:
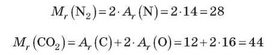
Якщо в хімічній формулі речовини є дужки, то перед обчисленням їх необхідно розкрити, наприклад:
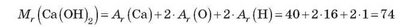
Відносні молекулярні маси речовин, у складі яких містяться атоми тільки одного хімічного елемента, прийнято вважати такими, що дорівнюють їхній відносній атомній масі, наприклад:
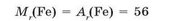
Знаючи відносну молекулярну масу, можна обчислити абсолютну масу молекули речовини Х (у грамах).
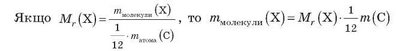
Якщо відносна молекулярна маса води дорівнює 18, то маса молекули води дорівнює:
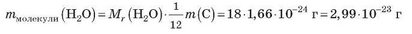
• Для речовин немолекулярної будови часто використовують термін «відносна формульна маса», але позначення цієї величини та її обчислення таке саме, як і для відносної молекулярної маси.
Висновки:
1. Відносна атомна маса — це відношення маси атома до 1/12 маси атома Карбону. Використовуючи відносну атомну масу, порівнюють маси атомів. Відносні атомні маси елементів наведено в Періодичній системі.
2. Масу молекул також визначають, порівнюючи з масою 1/12 маси атома Карбону. Молекулярну масу обчислюють як суму відносних атомних мас елементів, що містяться у складі молекул.
Контрольні запитання
1. Дайте визначення поняттям «відносна атомна маса», «відносна молекулярна маса». Що в даному випадку означає слово «відносна»?
2. Виберіть правильну відповідь. Атомну одиницю маси використовують: а) для обчислення відносної атомної маси елементів; б) як одиницю вимірювання атомної та молекулярної маси; в) для обчислення мас усіх маленьких частинок; г) для обчислення мас великих тіл.
3. Виберіть правильну відповідь. Атомна одиниця маси дорівнює: а) 1/12 маси атома Оксигену; б) 1/12 маси атома Карбону; в) масі електрона, помноженій на 12; г) 1,66 х 10-24 г.
4. Чому масу атомів рідко виражають у грамах?
5. Що спільного і чим відрізняються такі поняття: а) «маса атома» і «відносна атомна маса»; б) «відносна молекулярна маса» і «маса молекули»; в) «відносна молекулярна маса» і «відносна атомна маса»?
Завдання для засвоєння матеріалу
1. Укажіть у Періодичній системі та випишіть символи і відносні атомні маси (з округленням до цілих чисел) хімічних елементів: Алюмінію, Флуору, Цинку, Аргентуму, Стануму.
2. Обчисліть, атом якого елемента важчий і у скільки разів: а) Нітроген і Гелій; б) Оксиген і Сульфур; в) Ферум і Силіцій; г) Сульфур і Купрум.
3. Обчисліть, скільки атомних одиниць маси міститься в 1 г речовини.
4. Скільки атомів Оксигену мають таку саму масу, як один атом Купруму?
5. Обчисліть відносні молекулярні (формульні) маси таких речовин: хлор СІ2, сульфатна кислота И2Б04, сахароза С12Н22011, мідь Си, гіпс СаБ04, крейда СаС03, малахіт (Си0Н)2С03.
6. Обчисліть, що важче: п'ять молекул води Н20 чи три молекули вуглекислого газу С02.
7. У «перекису водню (гідроген пероксиді)» на один атом Оксигену припадає один атом Гідрогену. Визначте хімічну формулу перекису водню, якщо його молекулярна маса дорівнює 34.
8. Речовина пірит складається з атомів Феруму та Сульфуру і має відносну формульну масу 120. Визначте хімічну формулу цієї речовини.
9. Визначте відносні атомні маси поданих елементів, використовуючи маси їхніх атомів: а) Платини, якщо маса її атомів 3,24 ■ 10-25 кг; б) Урану, якщо маса його атомів 3,95 ■ 10-22 г. Відповідь порівняйте зі значеннями, указаними в Періодичній системі.
10. Формула жасмоналю, що має запах квітів жасмину, С6Н5СНС(С5Н11)СНО. Обчисліть його відносну молекулярну масу.
11. Обчисліть масу молекули сахарози С12Н22О11 у грамах, визначте, скільки молекул сахарози міститься у зразку цукру масою 1 г.
12*. Як у ХУІІ-ХІХ століттях визначали відносну атомну масу (атомну вагу)? Маси яких елементів були взяті за основу для визначення відносних атомних мас? Чому в сучасній хімії для визначення відносних атомних мас використовується карбонова одиниця?
Це матеріал з підручника Хімія 7 клас Григорович
Автор: admin от 18-01-2017, 22:36, Переглядів: 10302