§ 7. Розрахункові задачі: обчислення відносної молекулярної маси речовини за її формулою
У цьому параграфі ви повторите:
• що таке відносна молекулярна та відносна формульна маса речовини;
• як позначають відносну молекулярну масу та як її обчислюють;
• у яких одиницях обчислюють відносну молекулярну масу.
Якщо однією з важливих кількісних характеристик атома є його відносна атомна маса (Ar), то для речовин — це відносна молекулярна маса (Mr). Вона дорівнює відношенню маси молекули певної речовини до 1/12 маси атома Карбону lJjC, відпоєна атомна маса якого 12. Це безрозмірна величина, яку обчислюють за хімічною формулою речовини.
Відносна молекулярна маса речовини дорівнює сумі відносних атомних мас усіх елементів, що входять до складу молекули.
Якщо формулу речовини умовно записати у вигляді XiYyZ2, то її відносну молекулярну масу молена розрахувати за формулою Mr (XYZ1) = хАг (X) + yAr (Y) + zAr (Z), де Ar — відносна атомна маса елемента, х, у, z — число атомів кожного елемента в складній речовині.
З урахуванням цього відносна молекулярна маса, наприклад, ортофосфатної кислоти H3PO1 дорівнюватиме:
Mr (H3PO1) = SAr (H) + Ar (P) + 4Ar (O) =
= 3 • 1 + 31 + 4 • 16 = 98.
Речовина H3PO1 утворена атомами неметалічних елементів, тому вона складається з молекул, тобто має молекулярну будову.
А як записати, наприклад, формулу кухонної солі? Ця речовина утворена йонами типового иеметалічиого елемента Хлору та йонами типового металічного елемента Натрію. Тому вона має йон-ну, або, як кажуть, немолекуляр-ну будову.
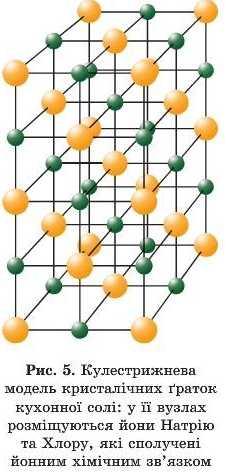
У твердому стані речовини кожний з йонів Натрію оточений шістьма йонами Хлору, а кожний йон Хлору — шістьма йонами Натрію (рис. 5). Тоді формулу натрій хлориду потрібно було б подати як Na0Cl0. Але через те що найменше кількісне співвідношення між числами йонів Натрію та Хлору становить 1:1, формулу натрій хлориду умовно записують як NaCL У цьому випадку мають на увазі умовну частинку складу NaCL Формула вказує на склад і найменше кількісне співвідношення йонів у сполуці.
Такі формули називають формулышми одиницями, а молекулярні маси, обчислені за цими формулами, — відносними формульпими масами.
Розраховують їх так само, як і відносні молекулярні маси. Наприклад, відносна формульна маса калій нітрату KNO3 дорівнює:
Mr (KNO3) = Ar (K) + Ar (N) + SAr (O) =
= 39 + 14 + 3-16 = 101.
За звичайних умов речовини немолекулярної будови (на відміну від переважної більшості речовин молекулярної будови) перебувають тільки в кристалічному стані. Виділити окрему частинку речовини з такого стану неможливо. Але і в цьому випадку склад речовин немолекулярної будови передають так само, як і речовин молекулярної будови, — за допомогою формул.
• Запитання та завдання
0 1. Що називають відносною молекулярною масою?
Яким символом її позначають?
2. Розрахуйте відносну молекулярну масу або відносну фор-мульну масу сполук: вуглекислого газу CO2; сульфатної кислоти H2SOi; цукру C12H22O11; етилового спирту C2H6O; мармуру CaCO3.
3. За значенням валентності атомів складіть формули окси-генових і гідрогенових сполук та обчисліть їхні відносні молекулярні маси:
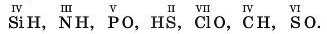
4. За значенням валентності атомів розставте індекси у формулах сполук і обчисліть, у скільки разів абсолютна маса молекули однієї речовини більша за абсолютну масу молекули другої речовини:
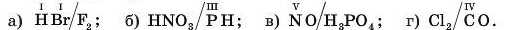
5. Відносні формульні маси FeO та сполуки Кальцію із Суль-фуром однакові. Складіть формулу сполуки Кальцію.
6. Відносна молекулярна маса H2S удвічі більша, аніж відносна молекулярна маса сполуки Гідрогену з Нітрогеном. Складіть формулу цієї сполуки.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:41, Переглядів: 2910