§ 2. Відносна молекулярна маса, її обчислення за хімічною формулою. Масова частка елемента в складній речовині
Повторивши матеріал параграфа, ви зможете:
• розрізняти поняття «відносна молекулярна маса», «відносна формульиа маса», «масова частка елемента»;
• обчислювати відносну молекулярну масу речовини за її формулою; масову частку елемента в складній речовині.
Відносна молекулярна маса речовини. З курсу хімії 7 класу вам відомо, що атоми елементів мають певну масу. Оскільки молекули й інші структурні частинки речовин складаються з атомів, то їм властива кількісна характеристика. Однак маси атомів, як і маси інших структурних частинок речовини, малі, через це користуватися ними під час обчислень практично дуже важко. Тому вчені запропонували використовувати не абсолютні, а відносні атомні й молекулярні маси. Позначаються вони відповідно так: А, і M,.
Пригадайте, у чому різниця між цими поняттями.
Відносна молекулярна маса це число, яке показує, у скільки разів маса певної молекули більша від — маси атома Карбону.
Обчислюють її за сумою відносних атомних мас елементів, з яких складається молекула. Розглянемо приклад.
Вправа 1. Обчисліть відносну молекулярну масу карбонатної кислоти.
Mr(H2CO3) = 2Д/Н) + Ar(C) + ЗАXО) = 2 · 1 + 12 + 3 · 16 = = 2 + 12 + 48 = 62.
Для речовин немолекулярної будови (йопіюї, атомної) використовують термін «відносна формульиа маса», що означає відношення маси формульної одиниці до -pj маси атома Карбону.
Позначають, як і відносну молекулярну масу, Mr, обчислюють аналогічно. Розглянемо приклад.
Вправа 2. Обчисліть відносну формульпу масу калій ортофосфату K3PO4.
іЩ K3PO4) = ЗД<К) + Ar(P) + 44/0) - 3 · 39 + 31 + 4 · 16 - 112.
Обчислення масової частки елемента в складі речовини.
Масові частки елементів у складі речовини обчислюють за хімічною формулою.
Як вам відомо, масова частка елемента це відношення маси елемента до маси сполуки. Виражається формулою:
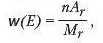
де W(E) масова частка; п ч исло атомі в елемента; А, відносна атомна масса; Mr — відносна молекулярна (формульпа) маса. Якщо ж необхідно обчислити масову частку у відсотках отриманий результат треба помножити на 100 %. Пригадати, як обчислюють масову частку елемента, вам допоможуть задачі.
Задача 1. Обчисліть масову частку Карбону в карбон(ІУ) оксиді.
Спочатку робимо короткий запис умови задачі (ліворуч), у якому вказуємо, що відомо й що потрібно обчислити.
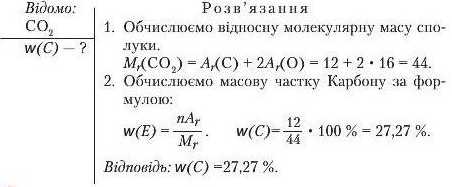
ПІД C У MO ВУЄМ О UOB ГОРЕЦЬ'
• Відносна молекулярна маса — це число, яке показує, у скільки разів маса певної молекули більша відмаси атома Карбону.
Обчислюється за сумою відносних атомних мас елементів, що входять до складу сполуки. Застосовується під час обчислення відносних молекулярних мас речовин із молекулярною будовою.
• Відносна формульна маса — відношення маси формульної одиниці до маси атома Карбону. Позначається й обчислюється, як відносна молекулярна маса. Застосовується для сполук із немолекулярною будовою (атомних і йонних).
• Масова частка елемента — це відношення маси елемента до
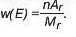
маси сполуки, що виражається формулою:
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Обчисліть відносні молекулярні маси сполук:
а) N2, SO2, CuO, NaCI;
б) SO3, B2O3, Mn2Oy1 HNO3;
в) H3PO4, Na2CO3, AI(OH)3, AI2(SO4)3.
2. Обчисліть масові частки елементів у сполуках: а) Літію — у літій оксиді; Кальцію — у кальцій хлориді CaCI2; Натрію — у натрій гідроксиді NaOH; б) Магнію — у магній оксиді; Фосфору — у фосфор(У) оксиді; Нітрогену — у нітратній кислоті HNO3;
в) Сульфуру — у натрій сульфіді Na2S; Алюмінію — в алюміній оксиді; Фосфору — в ортофосфатній кислоті Н3Р04.
3. Обчисліть масові частки елементів у сполуках: а) Фосфору й Гідрогену — у фосфіні PH3; Барію й Оксигену — у барій карбонаті BaCO3; Кальцію й Оксигену — у кальцій гідроксиді Ca(OH)2; б) Купруму й Оксигену — у купрум(І) оксиді; Калію та Сульфуру — у калій сульфіті K2SO3; Калію й Гідрогену — у калій гідроксиді KOH.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 18-09-2016, 23:33, Переглядів: 5332