Відносна густина газів
В Італії є печера, яка має вулканічне походження, її називають «Собача печера». Люди відвідують Ci без особливого ризику для свого життя. Собаки ж та інші низькорослі тварини гинуть, бо вулканічний грунт місцевості, де розміщується печера, постійно виділяє вуглекислий газ, який стелиться низом, утворюючи шар висотою 80-100 см.
Пригадайте! Чому в печері вуглекислий газ збирається саме внизу?
7. Обчисліть об'єм газу кількістю речовини 4 моль.
8. Обчисліть кількість речовини, якщо відомо, що:
а) об'єм азоту становить 33,6 л (н. у.);
б) об’єм вуглекислого газу становить 22,4 м3;
в) об'єм нітроген(І) оксиду становить 672 мл;
г) маса кисню у балоні — 3 кг;
д) порція цукру містить 18 · 10гз молекул.
9. Обчисліть об'єм (н. у.) сульфур(ІУ) оксиду кількістю речовини 0,5 моль.
10. Обчисліть густину водню, кисню, азоту (н. у ).
11. Обчисліть об'єм (н. у.), якщо відомо:
а) маса гелію становить 3,2 г;
б) число молекул хлор(І) оксиду становить 3,01-1023.
12. Порівняйте маси кисню та метану CH4, якщо Tx узято в об’ємах 3 л (н. у.).
13. Порівняйте об’єми (н. у.) аргону масою 4 г та неону, число молекул якого становить 6,02-1022.
14. Який об'єм займе кисень масою 2,5 кг (н.у.), якщо його перевести з рідкого стану в газуватий, випустивши з балону.
15. Виведіть формулу газу, молекули якого двохатомні, якщо 1 л цього газу має масу 1,25 г.
Причина в тому, що різні гази мають різну масу. Маси 1 моль або 22,4 л (н. у.) вуглекислого газу та кисню становлять 44 г та 32 г відповідно. Отже, вуглекислий газ важчий за кисень у 1,375 разів.
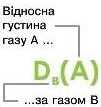
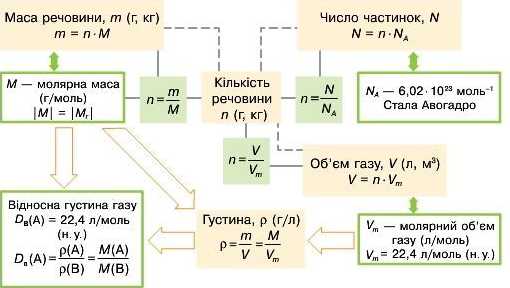
Співвідношення мас однакових об’ємів газів, експериментально виміряних за однакових умов, це фізична величина — відносна густина газу.
Відносна густина газу позначається Da(A),індексом вказують формулу газу, з яким порівнюють, а в дуж-
ках записують формулу газу, відносну густину якого визначають:
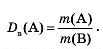
Для зручності підрахунків використовують значення молярних або відносних молекулярних мас.
Відносна густина газу — це відношення молярних або відносних молекулярних мас порівнюваних газів.
Математичні вирази для обчислення відносної густини газу:
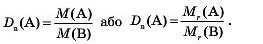
Відносна густина газу — безрозмірна величина.
Якщо гази взято об’ємом 1 л, то їхня маса дорівнюватиме абсолютній густині. Отже, відносну густину газів можна виразити і як співвідношення значень абсолютних густин.
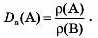
Якщо порівняємо густину двох газів кількістю речовини 1 моль (н. у.), то сніввідношення густин буде мати вигляд:
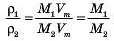
Пам’ятайте!
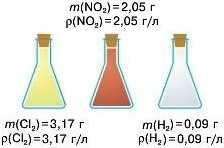
Однакові об'єми будь-яких газів містять однакове число молекулу але мають різну масу.
Відносну густину газу використовують для виведення молекулярних формул багатьох газуватих сполук за молярною чи відносною молекулярною масою.
M(A)=Dn(A)-M(B)
ТЕМА З

Молярну масу повітря обчислено, за вмістом основних компонентів кисню та азоту: М(повгтря) = 0,21 -32г/моль+ +0,78· 28г/моль=29г/моль.
Пригадаємо історію «Собачої печери». Щоб пояснити це явище, нам слід математично порівняти маси вуглекислого газу та цовітря. Повітря — це суміш газів. Його молярну масу обчислено теоретично:
M (повітря) = 29 г/моль.
Відповідно маємо 44 г/моль: 29 г/моль = 1,517. Отже, вуглекислий газ у півтора рази важчий за повітря. Тобто:
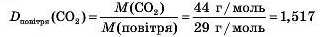
Відносна густина вуглекислого газу за повітрям становить 1,517.
Хімія в нашому житті
Уміння обчислювати відносну густину одного газу за іншим допоможе прийняти правильне рішення ііід час техногенних аварій, пожеж. Так, якщо на промисловому підприємстві станеться витік амоніаку, необхідно спускатися на нижні поверхи або у підвал. У разі небезпеки витоку хлору, слід дочекатись рятувальників на верхніх поверхах будівлі. Під час пожежі слід залишати приміщення поповзом, щоб не вдихати чадного газу.
У 1783 році у Парижі була запущена перша повітряна куля, наповнена воднем.
Пізніше у французькій армії був організований корпус повітряних суден — військових аеростатів, з яких інженери проводили розвідку.
Для розрахунків часто використовують відносну густину газу за повітрям Dnoo, воднем Dn, киснем D0 , вуглекислим газом Dcо, тощо.
Обчислення з використанням відносної густини газів
Приклад J. Щоб з’ясувати, чому повітряні кулі — аеростати, наповнені воднем, піднімаються вгору, обчисліть відносну густину водню за повітрям.
Розв’язування


Відповідь: відносна густина водню за повітрям становить 0,069, він у 14,5 разів легший за ловітря.
Приклад 2.Обчисліть відносну густину силану SiH4 за гелієм.
Розв’язування
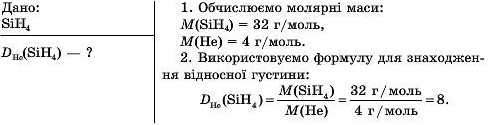
Відповідь: відносна густина силану SilI4 за гелієм 8, отже, цей газ у 8 разів важчий за гелій.
Приклад 3.Виведіть формулу сполуки, що складається з атомів Оксигену, відносна густина за воднем якої становить 24. Залишіть назву цієї сполуки.
Розв’язування

Попрацюйте в групах. Виконайте вправу «З—2—І». Наведіть три аргументи за вивчення кількісних відношень у хімії. Проаналізуйте схему та складіть умови двох задач. Вкажіть одну найскладнішу для розуміння формулу, тезу, поняття. 8
Узагальнюємо набуті знання з теми «Кількість речовини.
Розрахунки за хімічними формулами»
У завданнях 1-12 вкажіть одну правильну відповідь.
1. Виберіть означення молярної маси.
А маса однієї молекули речовини Б найменша маса речовини
В найбільша маса речовини Г маса одного моль речовини
2. Виберіть означення кількості речовини.
А величина, що визначають певною кількістю атомів у молекулі Б величина, що показує число структурних частинок у певній порції речовини В величина, що визначають масою одного моль речовини Г величина, що показує число структурних частинок у 100 г речовини
3. Виберіть означення відносної густини газів.
А це відношення маси газу до його об'єму Б це відношення об’єму газу до його маси
В це відношення молярної маси одного газу до молярної маси іншого Г це відношення маси газу до молярної маси цього газу
4. Виберіть твердження, що стосується 1 моль речовини.
А порція речовини, яка містить 6,02-1022 її формульних одиниць Б порція речовини, яка містить 6,02-1023 її формульних одиниць В порція речовини, яка містить 12,04-1023 її формульних одиниць Г певна речовина, яка містить 6,02-1023 її формульних одиниць
5. Укажіть одиницю вимірювання кількості речовини.
А грам Б паскаль В моль Г літр
6. Виберіть символ, яким позначають молярну масу.
A Na Б N В M Г т
7. Укажіть значення постійної величини молярного об'єму газу за нормальних умов.
А 24,2 л/моль Б 22,4 л/моль В 2,24 л/моль Г 224 л/моль
8. Укажіть значення відносної густини кисню за воднем.
А 0,125 Б 8 В 16 Г 32
9. Укажіть, яке число молекул міститься у кисні кількістю речовини 2 моль.
A 3,01-1023 молекул
Б 6,02-1023 молекул В 12,04-1023 молекул Г 24,12-1023 молекул
10. Укажіть, яке число атомів міститься у водні кількістю речовини 2 моль.
А 3,01 Ю23 атомів
Б 6,02-1023 атомів В 12,04 1023 атомів Г 24,12-1023 атомів
11. Укажіть молярну масу кальцій оксиду CaO.
А 28 г/моль Б 55 г/моль В 56 г/моль Г 640 г/моль
12. Укажіть об'єм 3 моль азоту (н. у.).
А 6,72 л Б 22,4 л В 67,2 л Г 84 л
У завданнях 13-16 встановіть відповідність між:
13. Символами фізичних величин та одиницями їх вимірювання.
Символ Одиниця вимірювання
1 т А л/моль
2 M Б г
3 \>,п В л
4 Vm Г г/моль
Д моль
14. Масою та кількістю речовини.
Маса речовини, г Кількість речовини
1 40 г CaCO3 А 0,2 моль
2 20 г NaOH Б 0,02 моль
3 3,6 г H2O В 1 моль
Г 0,5 моль
15. Масою та об'ємом газу.
Маса газу, г Об'єм газу
1 0,32 г O2 А 22,4 л
2 71 г Cl2 Б 11,2 л
3 14 г N2 В 0,448 л
Г 0,224 л
16. Фізичною величиною та можливим значенням.
Фізична величина Значення
1 m(CaC03) А 100
2 M(CaCO3) Б 100 моль
3 MXCaCO3) В 100 г
Г 100 г/моль
Завдання з відкритою відповіддю.
17. Обчисліть число молекул сульфатної кислоти H2SO4 кількістю речовини
1.5 моль.
18. Обчисліть відносну густину за киснем сульфур(ІУ) оксиду.
19. Відносна густина за киснем деякого газу становить 0,5. Обчисліть молярну масу цього газу.
20. Обчисліть кількість речовини магній оксиду масою 1,6 г.
21. Який об’єм (н. у.) займає неон масою 2 г.
22. Обчисліть число йонів Zn2~,І в цинк йодиді Znl2 кількістю речовини
2.5 моль.
23. Маса 1 л газуватої речовини (н. у.) дорівнює 1,34 г. До її складу входять атоми Нітрогену та Оксигену. Масова частка Оксигену у сполуці становить 53,3 %. Знайдіть формулу речовини.
24. Відносна густина газу, що складається з атомів Гідрогену та Сульфуру, за киснем становить 1,06. Знайдіть формулу газу, якщо масова частка Гідрогену становить 5,89 %.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 22:01, Переглядів: 4509