Відносна густина газів
Після опрацювання параграфа ви зможете обчислювати відносну густину одного газу за іншим.
Густина — важлива кількісна характеристика газів. Потрібно знати її, щоб правильно використовувати газуваті речовини в практичній діяльності, на виробництві й у побуті. Яким газом заповнити повітряну кулю, щоб вона здійнялася в повітря й полинула в небесну височінь (рис. 19.1)? Чому в Собачій печері, що поблизу Неаполя (Італія), у якій безперервно виділяється вуглекислий газ, люди можуть перебувати, а собаки гинуть? Як хімік має розташувати посудину для збирання кисню витісненням повітря - отвором догори чи донизу? Як правильно «перелити» водень або вуглекислий газ з одного хімічного стакана до іншого? На ці та багато інших запитань ви зможете відповісти самостійно після вивчення параграфа.

Ви вже знаєте, що для характеристики мас атомів, молекул або інших структурних одиниць речовини застосовують величини, що дістали назву відносної атомної й відносної молекулярної маси речовини.
Для газуватих речовин особливе значення має відносна густина одного газу за іншим. Відносна густина D газуватої речовини X за газуватою речовиною Y дорівнює відношенню густин р цих газів, виміряних за однакових умов:

Отже, через особливі властивості газуватих речовин відносна густина газуватої речовини X за газуватою речовиною Y дорівнює відношенню молярних мас M цих газів. Цей взаємозв’язок відображає схема, зображена на рисунку 19.2.
Оскільки молярні маси речовин чисельно дорівнюють їхнім відносним молекулярним масам, то відносна густина газуватої речовини X за газу-ватою речовиною Y дорівнює відношенню відносних молекулярних мас Mr цих газів:
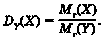
Аналіз формул визначення відносної густини доводить, що, як і будь-яка інша відносна величина, відносна густина одного газу за іншим не має одиниць вимірювання.
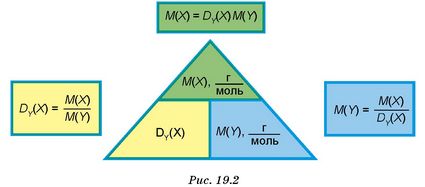
Найчастіше визначають відносну густину газу за воднем H2, киснем O2 та повітрям. Наприклад, у загальному вигляді формула обчислення відносної густини газу X за воднем матиме вигляд:
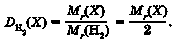
Запишіть у загальному вигляді формули обчислення відносної густини газу Х за: а) киснем; б ) повітрям. Зважте на те, що повітря - суміш газів (пригадайте,
яких саме), його середня молярна маса становить 29 —г—.
моль
Серед газів найменша густина - у водню, вона становить лише 0,08988 л,
найбільша - у вольфрам(УІ) флуориду - 12,9 —. Також важким газом є
л
сульфур(УІ) флуорид.
Аналізуючи схему на рисунку 19.1, легко дійти висновку, що за експериментально визначеною відносною густиною невідомого газу X за відомим газом Y можна обчислити молярну (а отже, й відносну молекулярну) масу невідомого газу X:
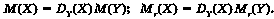
Формулу для визначення відносної молекулярної маси будь-якого газу за його відносною густиною за воднем або за повітрям уперше запропонував у 1856 році Д.І. Менделєєв.
Отже, тепер ви знаєте, що таке відносна густина одного газу за іншим та як її обчислити. Ці знання й уміння знадобляться вам під час розв’язування розрахункових задач. Пам’ятайте, що ви можете використати схему на рисунку 19.2 як своєрідний алгоритм. Розгляньмо приклади.
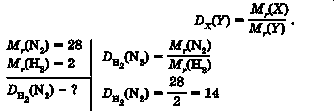
Задача 1. Обчисліть відносну густину азоту N2 за воднем.
Відповідь: відносна густина азоту за воднем становить 14.
Задача 2. Обчисліть середню молярну масу газової суміші, відносна густина якої за киснем становить 0,5.

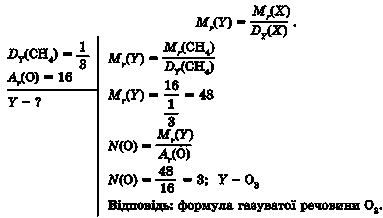
Задача 3. Визначте формулу газуватої речовини, утвореної атомами
Оксигену, якщо відносна густина метану CH4 за нею становить —.
3
ПРО ГОЛОВНЕ
• Відносна густина газуватої речовини X за газуватою речовиною Y дорівнює відношенню молярних мас M цих газів.
• Відносна густина газуватої речовини X за газуватою речовиною Y дорівнює відношенню відносних молекулярних мас Mr цих газів.
• Відносна густина одного газу за іншим не має одиниць вимірювання.
• За експериментально визначеною відносною густиною невідомого газу X за відомим газом Y можна обчислити молярну (а отже, й відносну молекулярну) масу невідомого газу.
Перевірте себе
1. Що таке відносна густина одного газу за іншим? 2. Як позначають відносну густину одного газу за іншим? 3. Які ще відносні величини відомі вам з курсу хімії?
Застосуйте свої знання й уміння
1. Поясніть відмінність між абсолютними й відносними величинами.
2. Поясніть взаємозв'язок між масою, об'ємом і густиною речовини.
3. Поясніть, яка з двох кульок (див. рис. 19.3) заповнена метаном СН4, а яка -сульфур(ІУ) оксидом SO2. Обчисліть відносну густину сульфур(ІУ) оксиду за метаном.

4. Обчисліть відносну густину озону O3 за киснем.
5. Обчисліть відносну густину сірководню H2S за амоніаком NH3.
6. Порівняйте відносну густину за воднем чадного СО та вуглекислого СО2 газу.
7. Обчисліть середню молярну масу газової суміші, відносна густина якої за азотом N2 становить 2.
8. З переліку виберіть пари хімічних формул тих газів, які мають однакову відносну густину за гелієм: O3,
CO2, CO, H2S, N2, CH4, C3H8.
9. Визначте хімічну формулу газуватої речовини, утвореної атомами Оксигену, якщо відносна густина вуглекислого газу CO2 за нею становить 1,375.
І Творча майстерня
і. Підготуйте відповіді на запитання, що були на початку параграфа.
2, Підготуйте за матеріалами Інтернету мультимедійну презентацію з фото та відео цікавих дослідів, які демонструють властивості найлегших і найважчих газів.
Дізнайтеся більше:
http://www.litmir.co/bd/?b=260980
тестовий контроль знань
1. Поняття «кількість речовини» 1811 року запровадив
А Каніццаро Б Авогадро В Бірингуччо Г Бернуллі
2. Число Авогадро дорівнює
А 6,02 • 1023 Б 22,4 В 6,02 Г 2,24 • 1023
3. Число молекул карбон(П) оксиду кількістю речовини 0,1 моль становить
А 6,02 • 1023 Б 6,02 • 1022 В 6,02 • 1021 Г 6,02 • 1020
4. Скільки атомів Алюмінію міститься в порції алюмінію масою 54 г?
А 6,02 • 1023 Б 6,02 • 1022 В 1,204 • 1024 Г 1,204 • 1025
5. Скільки йонів Натрію міститься в порції натрій сульфату Na2SO4 масою 14,2 г?
А 6,02 • 1023 Б 6,02 • 1022 В 1,204 • 1023 Г 1,204 • 1024
6. Маса (г) води кількістю речовини 3 моль становить
А 6,02 Б 5,4 В 22,4 Г 54
7. Молярна маса чисельно дорівнює
А кількості речовини Б масі молекули речовини В об'єму речовини Г відносній молекулярній масі
8. Молярна маса (—г—) озону О3 дорівнює
моль 3
А 3 Б 16 В 32 Г 48
9. Кількість речовини позначають символом
А N Б m В n Г ЫА
10. Молярна маса азоту N2 становить
А 14 г Б 28 г В 14 г Г 28 г
моль моль
11. Молярну масу позначають символом
А тг Б m В М Г Mr
12. Одиницею вимірювання кількості речовини є
А грам-молекула Б грам-моль В моль-1 Г моль
13. Об’єм (л) кисню кількістю речовини 0,1 моль за н. у. становить
А 224 Б 22,4 В 2,24 Г 0,224
14. Молярний об’єм речовини - це об’єм
А речовини масою 1 г Б речовини кількістю 1 моль В речовини масою 1 кг Г однієї молекули речовини
15. Об’єм (л) 6,02 • 1023 молекул азоту за н. у. становить
А 224 Б 22,4 В 2,24 Г 0,224
16. Кількість речовини (моль) хлору об’ємом 448 л за н. у. становить
А 1 Б 2 В 10 Г 20
17. Кількість молекул карбон(ІУ) оксиду об’ємом 2,24 л за н. у. становить
А 6,02 • 1023 Б 6,02 • 1022 В 6,02 • 1021 Г 6,02 • 1020
18. Метеорологічний зонд заповнено гелієм об’ємом 200 л. Формула, за якою потрібно обчислити кількість речовини гелію, - це
А 1 моль _ 22,4 л В 200 л г 22,4 л/моль
А 22,4 л Б 1 моль В 22,4 л/моль Г 200 л
19. Однакова кількість молекул міститься у
А воді масою 18 г і кисні масою 32 г Б воді об'ємом 18 см3 і кисні об'ємом 18 см3 В воді масою 18 г і кисні об'ємом 32 см3 Г воді масою 18 г і кисні масою 18 г
20. Відносна густина метану за киснем 0,5. Його відносна густина за воднем
А 4 Б 8 В 16 Г 32
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 03:07, Переглядів: 4382