Склад атома і періодична система
Чому властивості елементів та їхніх сполук змінюються періодично? Яка природа періодичності?
Пригадайте весняний садок. Весною стовбури плодових дерев «білять» розчином (суспензією) гашеного вапна. Як приготувати суміш для побілки? Можна купити одразу гягтгйнй канно Ca(OTT)2 та розчинити його у воді. Коли у вас буде негашене вапно CaO, потрібно провести хімічну реакцію між ним і водою.
Пригадайте! До яких оксидів: кислотних чи основних, належить
речовина CaO?
Складіть рівняння взаємодії кальцій оксиду з водою.
Усі газовані напої містять розчин карбонатної кислоти II2CO3. Вона утворюється за насичення води вуглекислим газом CO2.
Пригадайте! До яких оксидів: кислотних чи основних, належить
COs? Складіть рівняння взаємодії карбон(ІУ) оксиду з водою.

Попрацюйте в парах. Проаналізуйте малюнок 25. У якій посудині розчинили кальцій оксид, а в якій карбон(ІУ) оксид. Чому ви так думаєте?
Після випробування розчинів індикаторами, помічаємо, що кольори індикатора відрізняються, бо ми отримали гідрати оксидів різного характеру. Гідрат кальцій оксиду — це луг, а гідрат карбон(ІУ) оксиду — це кислота.
Пам’ятайте! Якщо доведеться допомагати готувати суміш для білення дерев, розчиняти кальцій оксид у воді потрібно дуже обережно, адже відбувається хімічна реакція з виділенням тепла. Працювати з такою сумішшю краще в гумових рукавицях і використовувати захисні окуляри.
У попередньому параграфі йшлося про уміння записувати електронні формули атомів елементів. Це допоможе встановити, як хімічні властивості речовин залежать від будови електронних оболонок атомів елементів, з яких вони утворені.
Два оксиди, що мають різні властивості, утворені різними елементами: металічним елементом Кальцієм та неметалічним — Карбоном.
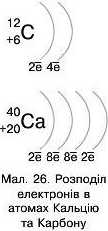
Розглянемо будову зовнішніх енергетичних рівнів атомів Кальцію та Карбону.
Кальцій розміщений у 4 періоді та має 20 електронів. Карбон розміщений у 2 періоді й має 6 електронів.
Електронна формула Кальцію: Is2 2a22pe 3s23pe4s2.
Електронна формула Карбону: Is2 2з22р2.
На зовнішньому енергетичному рівні в атомі Кальцію є лише два електрони, а в Карбону їх чотири (мал. 26).
Число зовнішніх електронів і характер елемента
З числом зовнішніх електронів пов’язані найважливіші властивості атома. Так, в хімічних реакціях атоми, на зовнішньому рівні яких мало (1-3) елек-
тронів, виявляють металічний характер або металічні властивості. І навпаки, елементи, атоми яких мають 4 й більше валентних електронів — виявляють немета-лічний характер.
І Поміркуйте! Елементи яких груп мають більш виражені металічні властивості? Чому?
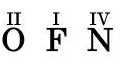
Саме зовнішні електрони беруть участь в утворенні сполук, тому їх називають валентними. Число валентних електронів визначають номером групи. Проте існують винятки: валентність Оксигену постійна і становить два, Флуору — один. Нітроген, хоч і утворює сполуку складу N2Os— білу кристалічну речовину, його вища валентність становить 4 (табл. 3). Чому саме? Детальніше ви дізнаєтесь про де пізніше.
Таблиця З
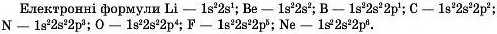
Елементи 2-го періоду періодичної системи
|
Групи |
І |
Il |
III |
IV |
V |
Vl |
Vll |
Vlll |
|||
|
Елементи |
Li |
Be |
в |
C |
N |
O |
F |
Ne |
|||
|
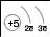
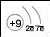
Заряд ядра атома |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
+9 |
+ 10 |
|||
|
Будова атома |
 |
 |
 |
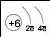 |
 |
 |
 |
 |
|||
|
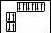
Графічна формула |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
|
|
И |
 |
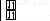 |
 |
 |
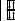 |
 |
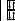 |
 |
 |
||
|
Число зовнішніх електронів |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|||
|
Оксид і його характер |
|||||||||||
|
Основний Амфоіерний Кислотний |
Li2O |
BeO |
B2O3 |
CO2 |
N2Ori |
||||||
|
Гідрат оксиду та його характер |
|||||||||||
|
Основний Амфотерний Кислотний |
LiOH |
Be(OH)2 |
H3BO3 |
H2CO3 |
HNO3 |
||||||
Радіус атома та характер елемента
У межах кожного періоду металічні властивості послаблюються та змінюються на неметалічні, які посилюються зі зростанням порядкового номера елемента.
Це пов’язано також ще з однією характеристикою атома — його радіусом.
Радіус атома — це умовний відрізок від центру атома до останнього заповненого електронами, тобто зовнішнього енергетичного рівня.
Розглянемо в таблиці зображення будови атомів елементів II періоду. Зі збільшенням заряду ядра радіуси атомів зменшуються, кількість енергетичних рівнів залишається однаковою. Сила притягання між позитивним ядром і негативно зарядженими електронами збільшується в атомах послідовно — від Літію до Флуору. Тому, своєю чергою, відбувається поступове зменшення радіуса атома. Валентні електрони в атомах металічних елементів слабше утримуються ядром, тому за хімічної взаємодії атоми металічних елементів втрачають свої зовнішні електрони та перетворюються на заряджені частинки.
Періодичність зміни властивостей
При нереході до наступного третього періоду в елемента Натрію заповнюється ще один енергетичний рівень — третій, і відбувається різка зміна властивостей, порівняно з Флуром і Неоном. А далі прослідковують таку саму закономірну зміну властивостей, як і у другому періоді.
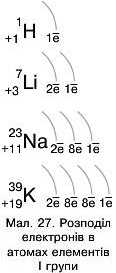
Активність металів пояснюють будовою їхніх атомів, а саме величиною радіуса. У групах, зі збільшенням заряду ядра, радіуси атомів збільшуються (мал. 27).
Що більший радіус атома металічного елемента, то проста речовина — активніший метал. Отже, у головних підгрупах зі збільшенням порядкового номера елемента у групі металічні властивості посилюватимуться, а неметалічні послаблюватимуться зверху донизу.
Поміркуйте! Як збільшення радіусів атомів елементів у групах впливає на інтенсивність їх взаємодії з водою?
Дослідимо головну підгрупу четвертої групи
Карбон і Силіцій — це неметалічні елементи, проте проста речовина кремній проводить електричний струм подібно до металів. Германій та Стан ум — металічні елементи.
Залежність властивостей сполук від електронної будови атомів
У таблиці наведено характери оксидів елементів 2 періоду періодичної системи: основний, амфотерний і кислотний. Зі збільшенням числа зовнішніх електронів спостерігають поступову зміну характеру оксидів: літій оксид — основний, берилій оксид — амфотерний, карбон(ІУ) оксид — кислотний. Оксидів Оксигену та Флуору не існує.
Що означає амфотерний оксид?
Амфотерність — від грец. — подвійний, двоякий.
Амфотерний оксид — це оксид металічного елемента, який, залежно від умов, виявляє кислотні й оснбвні властивості. Амфотерними є оксиди: BeO, Al2O3, ZnO та інші.
Деякі оснбвні оксиди реагують з водою, утворюючи гідрати основних оксидів або розчинні основи — луги.
Амфотерні оксиди не взаємодіють з водою, проте їм відповідають амфотерні гідроксиди: берилій гідроксид Be(OIl)2, алюміній гідроксид Al(OII)3, цинк гідроксид Zn(OH)2.
Кислотні оксиди майже всі утворюють з водою гідрати кислотних оксидів, які називають кислотами.
Основні властивості оксидів і гідратів оксидів зі збільшенням заряду ядра атома у періодах періодичної системи послаблюються, а кислотні властивості посилюються. Наприклад:
|
Формула оксиду |
Na2O |
MgO |
AI2O3 |
SiO2 |
Рг05 |
|
Характер |
Основний |
Основний |
Амфотерний |
Кислотний |
Кислотний |
|
оксиду |
оксид |
оксид |
оксид |
оксид |
оксид |
|
Формула гідроксиду |
NaOH |
Mg(OH)2 |
AI(OH)3 |
H2SiO3 |
H3PO4 |
|
Характер гідроксиду |
Луг |
Основа |
Амфотерний гідроксид |
Кислота |
Кислота |
У головних підгрупах навпаки: кислотні властивості оксидів і гідратів оксидів зі збільшенням заряду ядра атома елементів послаблюються, а оснбвні посилюються. Наприклад:
|
Формула оксиду |
Характер оксиду |
Формула гідроксиду |
Характер гідроксиду |
|
BeO |
Амфотерний оксид |
Be(OH)2 |
Амфотерний гідроксид |
|
MgO |
Основний оксид |
Mg(OH)2 |
Основа |
|
CaO |
Основний оксид |
Ca(OH)2 |
Луг |
За місцем хімічного елемента у періодичній системі можна пояснити будову його атома та снрогнозувати характер і властивості його сполук.
Закінчіть речення, вибравши 2-3, які вважаєте за
потрібне.
Я зрозумів (-ла), що ... . Було важко ... . Я дізнався (-лась) про ... . Я зумів (-ла)... . Мене здивувало ... . Було корисно ... . Тепер я умію ... . Я не зрозумів (-ла) ... .
1. Які електрони називають валентними? Чому?
2. Що таке радіус атома?
3. Як радіус атомів елементів одного періоду впливає на зміну властивостей їх сполук?
4. Як радіус атомів елементів однієї групи впливає на зміну властивостей їх сполук?
5. Встановіть число зовнішніх електронів в атомах:
Нітрогену, Сульфуру, Аргону.
6. Ранжуйте елементи за посиленням металічних властивостей:
А Хлор Б Фосфор В Магній Г Силіцій
7. Ранжуйте елементи за посиленням неметалічних властивостей:
А Бром Б Йод В Флуор Г Хлор
8. Складіть графічні й електронні формули Бору та Алюмінію. Спрогно-зуйте характер цих елементів і властивості простих речовин.
9. Обґрунтуйте, виходячи з будови атомів елементів, чому в ряду Нітроген, Фосфор, Арсен кислотні властивості послаблюються.
10. Запишіть рівняння реакції взаємодії простих речовин, які мають електронні формули атомів 1s22s22pb3s2 та 1s22s22p4.
11. Визначте елемент за електронною формулою Is^s^p'^s^p^s1. Запишіть формули його оксиду та гідроксиду. Спрогнозуйте характер елемента та властивості його сполук.
12. Визначте елемент, якщо відносна молекулярна маса його оксиду ЕОг становить 60. Складіть електронну формулу цього елемента. Спрогнозуйте характер його оксиду та гідрату оксиду.
13. Запишіть графічні формули Силіцію та Сульфуру. Вкажіть подібність і відмінність в електронних оболонках атомів і властивостях їхніх сполук.
14. Знайдіть інформацію, де у природі трапляється оксид елемента, встановленого у завданні 12.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:37, Переглядів: 2801