Періодична система хімічних елементів з позиції теорії будови атома
Перші уявлення про будову атомів і природу хімічної валентності... ґрунтувалися на закономірностях властивостей елементів, установлених за допомогою періодичного закону.
В. І. Спіцин
Після опрацювання параграфа ви зможете:
• аналізуватиінформацію, закладену в періодичній системі;
• використовуватиїї для характеристики хімічного елемента; класифікації елементів, визначення їхньої валентності, класифікації простих речовин, визначення хімічного характеру оксидів, гідратів оксидів, сполук елементів з Гідрогеном;
• обґрунтовуватифізичну сутність періодичного закону.
Структура періодичної системи зумовлена електронною конфігурацією атомів хімічних елементів. Порівнюючи будову зовнішнього енергетичного рівня атомів (рис. 9.1), легко дійти висновків:
• повторюваність властивостей хімічних елементів у головних підгрупах зумовлена періодичним повторенням структури зовнішнього енергетичного рівня їхніх атомів;
• кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп збігається з номером групи;
• кількість енергетичних рівнів у атомі дорівнює номеру періоду.
У цьому полягає фізичний зміст, періодичного закону, номеру групи й періоду.
Пригадайте, у періодах зі збільшенням протонних чисел відбувається поступовий перехід від металічних до неметалічних елементів. У головних підгрупах - навпаки, зі зростанням протонних чисел посилюються металічні властивості. Як це пов’язано з будовою електронних оболонок атомів?
В атомах металічних елементів на зовнішньому енергетичному рівні зазвичай від одного до трьох електронів. В атомах неметалічних елементів їх від чотирьох до восьми. Зі збільшенням числа зовнішніх електронів2 слабшають металічні й посилюються неметалічні властивості хімічних елементів (рис. 9.1). Наприклад, елемент третього періоду Натрій - металічний. Утворена ним проста речовина натрій - дуже активний метал. Трохи слабше металічні властивості виражені в Магнію. Ще менше - в Алюмінію. Силіцій - неметалічний елемент. Далі від Фосфору до Хлору неметалічні властивості посилюються. У тій самій послідовності змінюється хімічна активність відповідних простих речовин.
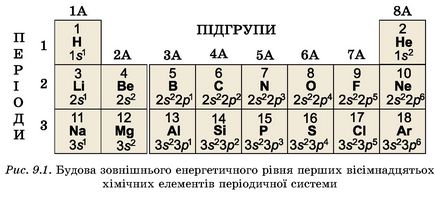
Зверніть увагу: в атомах інертних елементів зовнішній енергетичний рівень завершений. Саме це є причиною хімічної пасивності відповідних простих речовин - інертних газів.
У періодичній залежності від зміни електронних структур атомів хімічних елементів перебуває й радіус атома (рис. 9.2). Від нього та від заряду ядра залежить, є елемент металічним або неметалічним. Наприклад, у другому періоді від Літію до Флуору збільшується заряд ядра і кіль-
кість зовнішніх електронів. Число електронних шарів залишається незмінним. Отже, сила притягання зовнішніх електронів до ядра зростає, тож атом «стискається». Тому радіус атома від Літію до Флуору зменшується. Що менший радіус атома, тим сильніше зовнішні електрони притягуються до ядра. І тим сильніше в хімічного елемента виражені немета-лічні властивості.
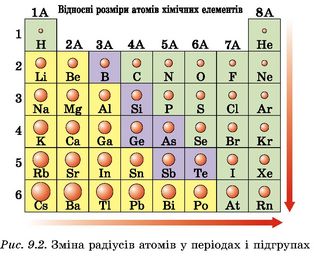
У VIIA підгрупі розташовані галогени: F, Cl, Br, I, At. На зовнішньому електронному шарі цих елементів однакове число електронів - 7. Із зростанням заряду ядра атома при переході від періоду до періоду збільшується число електронних шарів. A отже, збільшується атомний радіус і слабшають неметалічні властивості. Про кількісну характеристику, за якою неметалічні елементи відрізняють від металічних, ви дізнаєтеся з наступної теми.
Вища валентність хімічних елементів також змінюється періодично. Тому під кожною групою періодичної системи зазначено в загальному вигляді хімічну формулу вищого оксиду, а для елементів IV-VII - ще й формулу леткої сполуки з Гідрогеном.
Пригадайте алгоритм визначення валентності хімічних елементів за формулами двохелементних сполук. Визначте для кожної групи періодичної системи валентність хімічних елементів, яку вони виявляють у: а) вищих оксидах;
б) летких сполуках з Гідрогеном. Як у періоді змінюється валентність хімічних елементів у вищих оксидах і летких сполуках з Гідрогеном?
Виконавши завдання, ви пересвідчилися, що вища валентність хімічного елемента збігається з номером групи періодичної системи, до якої він належить.
Чи є винятки із цього правила? Так, існує кілька хімічних елементів, значення вищої валентності яких не збігається з номером групи в періодичній системі. Пригадайте, про це вже йшлося в курсі хімії 7 класу. Приміром, максимальна валентність Оксигену - елемента VIA підгрупи - II, а максимальна валентність Флуору - елемента VIIA підгрупи - І.
Чому? Дотепер ми не пояснювали причину цього явища. Тож спробуймо знайти відповідь на запитання, що виникло, розглянувши будову зовнішнього енергетичного рівня атомів цих елементів.
Виявлено, що максимальна валентність хімічного елемента визначається числом неспарених електронів у його атомі. Графічний варіант будови зовнішнього енергетичного рівня атомів зазначених елементів такий:

В атомі Оксигену два неспарених електрони, тому вища валентність елемента дорівнює двом. Флуор виявляє вищу валентність один, оскільки в його атомі один неспарений електрон.
Атоми можуть переходити у збуджений стан через надання їм додаткової енергії. Унаслідок цього спарені електрони можуть розпаровуватися. Вони переходять у межах зовнішнього енергетичного рівня з підрівня з нижчою енергією на підрівень з вищою енергією. Наприклад, в основному стані в атомі Бору один неспарений електрон. А в збудженому стані їх три, бо один з електронів 2є-підрівня перейшов на вільну орбіталь 2р-підрівня:

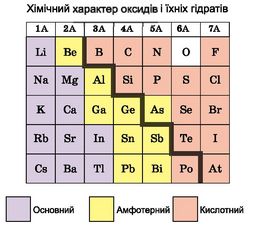
Чи залежить від положення хімічного елемента в періодичній системі хімічний характер його оксиду й гідрату цієї сполуки? З’ясуємо це на прикладі елементів третього періоду. Його розпочинає Натрій - лужний елемент. Натрій оксид Na2O - основний. Гідрат натрій оксиду NaOH -продукт його взаємодії з водою - луг, дуже їдка речовина. Магній оксид MgO і його гідрат Mg(OH)2 також мають основні властивості, хоча слабші, ніж в оксиду й гідроксиду Натрію. Саме тому магній гідроксид є складником лікарських засобів проти печії - не подразнює слизову травного тракту й зменшує кислотність шлункового соку. Так само у складі цих засобів є алюміній гідроксид Al(OH)3. Ця речовина виявляє амфотерні (подвійні) властивості - як основні, так і кислотні. Амфотерним є й алюміній оксид.
Амфотерність (від давньогрец. «подвійний», «обопільний») — здатність деяких сполук залежно від умов виявляти як кислотні, так і основні властивості.
Поняття амфотерність як характеристику подвійних властивостей речовин запровадили в 1814 р. французькі науковці Ж. Гей-Люссак і Л. Тенар. Німецький хімік А. Ганч сформулював таке визначення: «Амфотерність -здатність деяких сполук виявляти як кислотні, так і основні властивості залежно від умов і природи реагентів, що беруть участь у кислотно-основній взаємодії, особливо залежно від властивостей розчинника».
Оксиди та гідрати оксидів решти хімічних елементів третього періоду є кислотними (рис. 9.3).
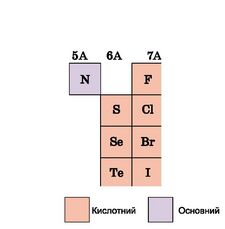
Який хімічний характер летких сполук хімічних елементів з Гідрогеном? Розгляньте рисунок 9.4. Як бачите, низка типових неметалічних елементів утворюють леткі сполуки з Гідрогеном. Усі ці газуваті речовини розчинні у воді. Водний розчин амоніаку NH3 має слабколужну реакцію, решта - кислу. Кислотні властивості летких сполук елементів з Гідрогеном посилюються в періодах зліва направо, у підгрупах - з верху до низу.
 |
 |
|
Рис. 9.3. Залежність хімічного характеру оксидів та їхніх гідратів від положення елемента в періодичній системі. Завдання. У якої речовини в ряду H2SiO3, H3PO4, H2SO4, HClO4кислотні властивості виражені найслабше? Найсильніше? |
Рис. 9.4. Хімічний характер летких сполук деяких хімічних елементів з Гідрогеном |
Виявлені закономірності свідчать: на елементному рівні (макросвіт) періодична система є узагальненням фактів, отриманих шляхом спостережень, вимірювань, експериментів. На атомному рівні (мікросвіт) це узагальнення одержало теоретичну основу.
ПРО ГОЛОВНЕ
• Структура періодичної системи зумовлена електронною конфігурацією атомів хімічних елементів.
• Повторюваність властивостей хімічних елементів у головних підгрупах зумовлена періодичним повторенням структури зовнішнього енергетичного рівня їхніх атомів.
• Кількість електронів на зовнішньому енергетичному рівні в атомах елементів головних підгруп збігається з номером групи.
• Кількість енергетичних рівнів в атомі дорівнює номеру періоду.
• Амфотерність - здатність деяких сполук залежно від умов виявляти як кислотні, так і основні властивості.
Перевірте себе
1. Чим зумовлена структура періодичної системи? 2. Чому елементи головних підгруп подібні за властивостями? 3. У чому полягає фізичний зміст періодичного закону? Номеру групи, періоду? 4. Як змінюються металічні й неметалічні властивості хімічних елементів у періодичній системі? 5. У якій частині періодичної системи розташовано найтиповіші неметалічні елементи? Металічні? 6. Які закономірності зміни радіуса атомів у періодичній системі? 7. Як змінюється вища валентність хімічних елементів у періодах і групах? 8. Як змінюється хімічний характер оксидів, їхніх гідратів, летких сполук елементів з Гідрогеном у періодичній системі?
Застосуйте свої знання й уміння
1. Визначте число електронів на зовнішньому енергетичному рівні в атомах: а) Стронцію; б) Селену; в) Йоду.
2. Визначте число енергетичних рівнів в атомах: а) Рубідію; б) Германію; в) Бісмуту.
3. В атомах яких з перелічених елементів однакове число енергетичних рівнів: Літій, Калій, Натрій, Магній?
4. Визначте найактивніший метал і найактивніший неметал.
5. В атомах яких з перелічених елементів однакове число електронів на зовнішньому енергетичному рівні: Літій, Натрій, Магній, Калій?
6. Визначте, який з елементів є металічним: Фосфор, Барій, Хлор.
7. Розташуйте за посиленням металічних властивостей такі елементи: а) Калій, Скандій, Кальцій; б) Рубідій, Натрій, Калій.
8. Розташуйте за посиленням неметалічних властивостей такі елементи: а) Хлор, Силіцій, Фосфор; б) Стибій, Фосфор, Сульфур.
9. Визначте, у якого з хімічних елементів другого періоду найбільший радіус атома.
10. Визначте, у якого з хімічних елементів ІА підгрупи найменший радіус атома.
11. Розташуйте елементи Галій, Арсен, Бром за збільшенням числа електронів на зовнішньому енергетичному рівні їхніх атомів.
12. Визначте вищу валентність Сульфуру, Арсену, Брому, Кальцію.
13. Складіть формули: а) вищого оксиду Стронцію та його гідрату; б) вищого оксиду Хлору та його гідрату; в) вищого оксиду Галію та його гідрату; г) леткої сполуки Селену з Гідрогеном. Зазначте хімічний характер цих сполук.
14. Визначте хімічний характер оксиду елемента з протонним числом 20.
15. Визначте хімічний характер гідрату оксиду елемента з протонним числом 34.
Творча майстерня
1. Поясніть зміст рисунка 9.5.
2. Напишіть вірш, коротку казку, загадку тощо про явище амфотерності. Або доберіть українські прислів'я, які б відповідали суті цього явища.
Дізнайтеся більше про зв’язок структури періодичної системи з будовою атомів хімічних елементів.
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 02:58, Переглядів: 4896