§ 12. Залежність властивостей елементів від періодичної зміни електронних структур атомів
Опрацювавши зміст параграфа, ви будете
• розуміти зміст понять «радіус атома», причини періодичного повторення властивостей хімічних елементів;
• уміти визначати характер хімічних властивостей елементів.
Ви вже знаєте, що в періодах у міру зростання заряд}' ядра атомів елементів послідовно змінюється структура зовнішнього енергетичного рівня (кількість валентних електронів). Саме з цим пов’язана зміна властивостей
елементів, тобто тих ознак, які становлять їх відмінну особливість. Такими ознаками можуть бути радіус атома, металічний або неметалічний характер елемента та його сполук тощо.
Радіус атома. У періодах із зростанням зарядів ядер атомів елементів притягання ядром електронної оболонки посилюється - відбувається своєрідне «стискання», і радіус атомів та йонів зменшується. Наприклад, у разі переходу від Літію Li до Неону Ne заряд ядра поступово збільшується (від +3 до + 10), що зумовлює зростання сил притягання електронів до ядра. Розміри атомів при цьому зменшуються. Тому на початку періоду розміщуються елементи, в яких невелике число валентних електронів (на зовнішньому енергетичному рівні) і великий радіус атома. А в групах навпаки: зі збільшенням кількості енергетичних рівнів радіус атома збільшується
У періодах зі зростанням протонного числа радіус атомів елементів зменшується, а в групах (головних підгрупах) - збільшується.
Зрозуміло, чим більший радіус атома, тим далі від ядра перебувають валентні електрони і тим слабкіше вони зв’язані з ядром, отже, легше від нього відриваються. Така структура атома характерна для металічних елементів.
Схарактеризуйте електронну будову атомів елементів, розміщених у
Періодичній системі наприкінці періодів, наприклад 2-го чи 3-го. До яких
родин елементів вони мають належати?
Зміна металічних і неметалічних властивостей елементів. Металічний або неметалічний характер елемента залежить від електронної будови його атома.
Розглянемо, наприклад, елементи 3-го періоду. Зверніть увагу, як закономірно змінюється електронна конфігурація атомів:
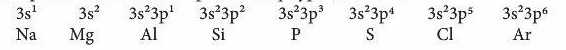
В атомах елементів від Na до Al на зовнішньому рівні мало електронів (1, 2, 3). Радіус атомів зменшується. Отже, зв'язок зовнішніх електронів з ядром поступово посилюється за рахунок притягання до ядра, і здатність атомів віддавати ці електрони зменшується. Це означає, що металічні властивості елементів від Naflo Al послаблюються (Al - перехідний елемент). Неметаліч-ні ж властивості навпаки посилюються від Силіцію до Фосфору і Сульфуру. Найяскравіше вони виражені у Хлору - галогену. Це пояснюється тим, що
I —HV-------------------------------------------------
зростає кількість електронів зовнішнього рівня, радіус атомів зменшується, отже, притягання до ядра посилюється, тобто здатність до приєднання електронів. Це означає, що неметалічні властивості посилюються.
Завершується 3-й період інертним елементом Аргоном Аг, який повторює головним чином властивості Неону Ne. В атомі Аргону зовнішній енергетичний рівень (8 електронів) так само завершений, тому при переході до наступного періоду властивості елементів різко змінюються, і 4-й період знову починається лужним елементом Калієм, який повторює переважно властивості Натрію.
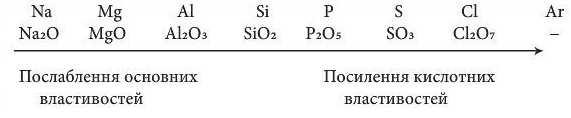
Відповідно до змін електронної будови зовнішнього енергетичного рівня закономірно змінюється значення вищої валентності елементів, отже, і склад їх оксидів:
Лабораторні досліди
У дві пробірки налийте розчин натрій гідроксиду і сульфатної кислоти, до кожної пробірки додайте по 2 краплі метилоранжу. До першої пробірки додавайте краплями розчин кислоти, до другої - лугу. Що спостерігається? Чому? Напишіть рівняння виконаних реакцій і зробіть висновок про характер гідратів оксидів Na і S(VI).
У пробірку налийте розчин алюміній хлориду і додавайте краплинами розчин лугу до утворення драглистої маси. Вміст пробірки розділіть на дві частини. До першої додайте розчин кислоти, до другої - лугу. Що спостерігається? Який висновок про характер алюміній гідроксиду можна зробити?
Отже, так само можна простежити й зміну характеру гідратів оксидів, що відповідають вищій валентності елемента
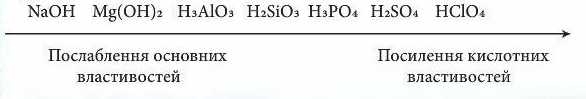
Висновки
Розміри атомів визначаються зарядом ядра і будовою електронної оболонки. Тому зміна радіусів атомів зі збільшенням протонного числа елемента має чітко виражений періодичний характер. У періодах радіус атомів поступово зменшується, а в головних підгрупах - збільшується.
Властивості хімічних елементів, розміщених у порядку зростання заряду ядра, змінюються періодично: у межах періоду металічні властивості елементів поступово послаблюються, а неметалічні - посилюються; основні властивості оксидів і гідроксидів елементів поступово послаблюються, а кислотні - посилюються. У головних підгрупах елементів навпаки.
Властивості хімічних елементів періодично повторюються, оскільки періодично повторюється будова зовнішніх енергетичних рівнів у їхніх атомах.
Завдання для самоконтролю
1. Поясніть причину періодичності в зміні властивостей хімічних елементів, розміщених у порядку зростання зарядів ядер їхніх атомів.
2. Як пояснити з погляду теорії будови атома зміну властивостей елементів у періодах від металічних до немєталічних?
3. Як пояснити хімічну пасивність інертних газів?
4. Наведіть приклади періодично повторюваних явищ, відомих вам у результаті вивчення інших предметів.
5. Зростання атомних радіусів спостерігається в ряду елементів:

6. Найбільший радіус атома має елемент:

7. Найінтенсивнішє реагуватимуть між собою:

8. Серед наведених електронних конфігурацій Оксигсну неправильною є:
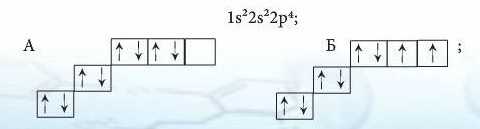
9. Характеристики атомів елементів, що перебувають у періодичній залежності від заряду ядра, - це:
А маса; В валентність;
Б радіус; Г металічні та неметалічні властивості.
Додаткові завдання
10. Скільки завершених енергетичних рівнів міститься в атомах елементів з протонними числами: а) 5; 6) 12; в) 18? Відповідь поясніть.
11. Формула вищого оксиду елемента із величиною заряду ядра +24 -це:
А ЕО; Б Е2О7; В ЕОз; Г Е2О3.
12. Формула сполуки з Гідрогеном елемента з протонним числом +32 -це:
А ЕН; Б EH2; В ЕНз; Г EH4.
13*. Знаючи протонні числа елементів 8, 13, 18, але не користуючись Періодичною системою, напишіть електронні формули атомів цих елементів і визначте їх хімічний характер.
14*. Елемент зі скороченою електронною конфігурацією атома ...
3dl04s2:
А металічний елемент;
Б розміщується у 3-му періоді;
В розміщується у головній підгрупі III групи;
Г має валентність 2.
15*. Елемент із протонним числом 114 повинен мати хімічні властивості, подібні до властивостей:
А Платини Pt; В Плюмбуму Pb;
Б Арсену As; Г Меркурію Hg.
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:13, Переглядів: 7381