Характеристика хімічного елемента за місцем у періодичній системі та будовою атома
Як за місцем елемента в періодичній системі визначити будову його атома й охарактеризувати властивості його сполук?
Періодичний закон і періодична система, як його графічне вираження, дозволяють прогнозувати і описувати властивості відомих хімічних елементів і навіть передбачати відкриття нових.
Пригадайте! Який фізичний зміст чисел у комірках періодичної системи?
За місцем елемента у періодичній системі можна визначати різні його характеристики, дізнатися про будову його атома та прогнозувати властивості сполук.
Для характеристики елемента важливе значення має його порядковий номер, який вказує на протонне число, заряд ядра, число протонів та електронів в атомі. За нуклонним числом можна визначити відносну атомну масу й порахувати число нейтронів в ядрі.
Для того щоб отримати повну характеристику елемента, потрібно враховувати номер групи та підгрупу, а також номер періоду.
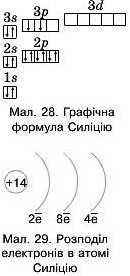
Паприк лад, охарактеризуємо Силіцій за місцем у періодичній системі та будовою його атома.
Силіцій — елемент під номером 14, отже, заряд ядра його атома Z = (+14), протонне число — 14, він має по 14 прогонів та електронів. Иуклонне число Силіцію становить 28, число нейтронів обчислюємо за формулою: N(ii°) =A- Ν(ρ*) = 28 - 14 = 14
Силіцій — елемент IV групи головної підгрупи (у довгоперіодному варіанті група ГХ'А). Має чотири валентні електрони на зовнішньому рівні — тобто вищу валентність за Оксигеном IV. Силіцій розміщений у третьому періоді, тож його атом має три енергетичні рівні. Складемо графічну та електрону формули Силіцію та спрогнозуємо його властивості (мал. 28, мал. 29).
Si: ls22s22pe3s23p2
Силіцій — неметачічний p-елемент, утворює просту речовину — неметал кремній.
Вищий оксид SiO2 має кислотний характер, йому відповідає гідрат оксиду — силікатна кислота Il2SiO3.
Із Гідрогеном Силіцій утворює летку сполуку SiH4 (силан), яка займається в повітрі, до того ж, ця сполука отруйна.
Пригадайте! Як змінюються металічні та неметалічні властивості у групах і періодах зі збільшенням заряду ядер атомів?
Порівняємо властивості Силіцію із сусідніми елементами в періоді та подібними елементами у групі.
Чотири зовнішні електрони атомів Силіцію тримаються слабкіше, ніж в атомі Карбону — неметалічного елемента. Та сильніше, ніж в атомі наступного у під-IrPyui елемента Германію — металічного елемента.
Ліворуч від Силіцію розміщений металічний елемент Алюміній, а праворуч — неметалічний Фосфор.
Можна стверджувати, що Силіцій є «слабким» не-металічним елементом.
Проста речовина кремній — тверда, має темно-сірий колір, скляний блиск і її використовують в мікроелект-роніці.
Алгоритм характеристики елемента за місцем в періодичній системі та будовою атома
1. Символ і назва елемента.
2. Будова атома:
• прогонне число;
• заряд ядра;
• кількість протонів;
• кількість електронів;
• нуклонне число;
• відносна атомна маса Ar;
• кількість нейтронів.
3. Місце в періодичній системі:
• період;
• група;
• підгрупа.
4. Будова електронної оболонки атома елемента: графічна та електронна формули.
δ. Вища валентність за Оксигеном.
6. Характер елемента (металічний, неметалічний).
7. Загальні відомості upo просту речовину (речовини).
8. Формула та характер (оснбвний, кислотний, амфотерний) вищого оксиду.
9. Формула та характер відповідного гідроксиду (кислота, основа, амфотерний гідроксид).
10. Формула леткої сполуки з Гідрогеном (для немета-лічних елементів).
11 .Порівняння властивостей елемента із властивостями сусідніх елементів у періоді та подібних елементів у групі.
Пам’ятайте! Для написання електронної формули використовуйте привило заповнення орбіталей I s<2s<2p<3s<3p<4s<3d<4p<5s <4d<5p<6s<4f<5d<6p<7...
Серед неметалічних елементів: 2з-елементи — Ні Не та 19 р-елементів — В, Cf Sif Nf Pf As, Of Sf Se, Te, Ff Cl, Br, I, Ne, Ar, Kr, Xe, Rn.
Попрацюйте у групах. Створіть інтелект-карту на основі комірки періодичної системи та алгоритму характеристики елемента за його місцем у періодичній системі.
Запитання та завдання
1. Яку інформацію, що закладено в періодичній системі, можна використати для класифікації елементів на металічні або неметалічні?
2. Як за періодичною системою можна визначити значення валентності елемента? Обґрунтуйте відповідь, використовуючи знання про будову атома.
3. Як спрогнозувати хімічний характер оксидів (кислотний, амфотерний, основний) елементів?
4. Встановіть відповідність.
А протонне число 1 число енергетичних рівнів
Б нуклонне число 2 заряд ядра
В номер групи 3 сума протонів і нейтронів
Г номер періоду 4 вища валентність за Оксигеном
5 число нейтронів
5. Встановіть відповідність.
Характер оксиду Гідрат оксиду
А основний оксид 1 кислота
Б кислотний оксид 2 амфотерний гідроксид
В амфотерний оксид 3 основа
6. Охарактеризуйте за поданим вище алгоритмом елементи з порядковими номерами: 6, 10, 12, 15.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:38, Переглядів: 38959