§ 45. Взаємодія основних оксидів з кислотними оксидами. Поширеність оксидів у природі. Використання оксидів
У цьому параграфі ви дізнаєтеся:
• які речовини утворюються в реакціях взаємодії основних і кислотних оксидів;
• якими кольорами забарвлюють довкілля природні оксиди;
• яку роль відіграють оксиди в природі та суспільному господарстві.
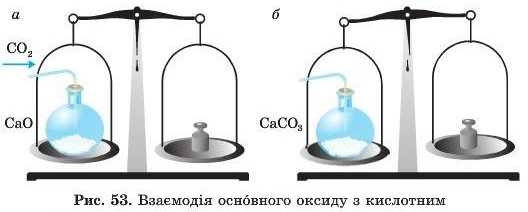
А чи взаємодіють кислотний та основний оксиди між собою? Проведемо дослід. У колбу помістимо порцію основного оксиду CaO і визначимо її масу. Потім через колбу пропустимо вуглекислий газ — карбон(ІУ) оксид CO2 (рис. 53, а). За деякий час, уважаючи, що відбулася реакція, пропустимо через колбу повітря, щоб витиснути зайвий більш важкий карбон(ГУ) оксид, який не прореагував. Знову визначимо масу колби: вона збільшилася (рис. 53, б). Отже, дійсно відбулася реакція:
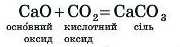
Як бачимо, продуктом реакції взаємодії основного оксиду з кислотним є сіль.
Знання хімічних властивостей оксидів дає можливість визначити, до якої групи оксидів — кислотних чи основних — належить той або інший оксид. Так, щоб довести кислотний характер оксиду, використовують його реакцію з лугом, а щоб довести основний характер — реакцію з кислотою.

Таке дослідження можна провести, якщо одну порцію оксиду додати до пробірки з лугом, а другу — до пробірки з кислотою. У разі відсутності ознак реакції в одній із пробірок та їхньої наявності в іншій можна визначити, яким є оксид — основним чи кислотним.
Демонстраційний дослід
Проведемо такий дослід, наприклад, з магній оксидом. Два невеличких шматочки магнію нагріємо над вогнем газового пальника, унаслідок чого обидва шматочки горять яскравим полум’ям з утворенням MgO — білого порошку, який є результатом взаємодії:
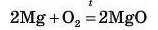
Одну з порцій зануримо в хімічний стакан із розчином хло-ридної кислоти ИС1 (рис. 54, а), який ми попередньо розігріли, аби реакція відбувалася з більшою швидкістю. Білий порошок MgO розчиняється з утворенням розчину солі MgCl :
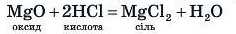
Другу порцію білого порошку MgO помістимо в розчин лугу NaOH, так само попередньо нагрітий (рис. 54, б). Протягом певного часу спостерігаємо за незмінною кількістю білого порошку: реакція не відбувається.
Таким чином, за реакцією з кислотою ми можемо стверджувати, що магній оксид є основним.
 |
 |
 |
|
Рис. 55. Кварц — один із найпоширеніших мінералів (SiO2), відомий у вигляді багатьох його різновидів |
Рис. 56. Гематит — природний CljepjlTVl(III) оксид Fe2O3; його кристали утворюють красиві зростки — «гематитові троянди» |
Рис. 57. Магнетиту Fe3O4 притаманний сильний магнітизм: біля його зразка стрілка компаса відхиляється |
Отже, на підставі досліджень хімічних властивостей оксидів ми дійшли висновків: основні оксиди реагують із кислотними оксидами та кислотами, а кислотні оксиди — з основними оксидами та основами з утворенням солей.
Оксиди в природі. Використання оксидів. Деякі оксиди, наприклад SiO2, CO2, H2O, Fe3O4, Fe2O3, MnO2, Al2O3, TiO2, широко розповсюджені в природі, але більшість із них отримують синтетичним способом. Існують оксиди NO, NO2, що утворюються періодично внаслідок природних явищ — під час грозових дощів. Ці оксиди, а також SO2 можуть бути й результатом викидів в атмосферу відходів окремих промислових підприємств.
Силіцій(ІУ) оксид SiO0 найчастіше трапляється в природі у вигляді піску. Його застосовують у будівництві, а також у виробництві скла, цементу, кераміки. Прозорі безбарвні або різноманітно забарвлені кристали кварцу SiO0 — дорогоцінні камені, наприклад безбарвний гірський кришталь, фіолетовий аметист, жовтий цитрин, чорний моріои тощо (рис. 55).
Карбоп(ГУ) оксид CO2, або вуглекислий газ, міститься у повітрі (0,03 % за об’ємом) і у водах мінеральних джерел. У природі він утворюється в процесі дихання живих істот (за добу людина видихає 500 дм3 CO2), гниття залишків рослин та тварин, згорянні палива, а також під час випалювання вапняку CaCO3, спиртового бродіння глюкози. Його застосовують у виробництві цукру, соди Na2CO3, для газування напоїв, а також як компонент вогнегасників, оскільки CO2 не горить і не підтримує горіння.
Під тиском 5,11 МПа за температури 20 0C вуглекислий газ перетворюється на снігоподібну масу, унаслідок випаровування якої температура навколишнього середовища знижується до -78,5 °С. Тому твердий CO2 («сухий лід») застосовують для зберігання харчових продуктів, морозива.

Вуглекислий газ поглинається разом із водяною парою зеленими рослинами, під дією світла він перетворюється на необхідні людині органічні речовини та кисень. Це явище називають фотосинтезом.
Але у великій кількості CO2 є небезпечним для людини і тварин: через його вдихання настає задуха.
Оксиди Fe2O3 (рис. 56), Fe3Oi (рис. 57), MnO2, Al2O3 (рис. 58), TiO0 використовують для добування з них відповідних металів.
і Приклад розв’язування задач
З якими з оксидів K2O, P2O., SO2, BaO, NiO, CrO3 взаємодіє: а) вода; б) луг NaOH; в) кислота HNO3? Якими рівняннями реакцій це можна передати?
Розв'язання
1. З водою взаємодіють лише ті оксиди, яким відповідають розчинні у воді основи та кислоти (див. таблицю «Розчинність солей, кислот та основ у воді», наведену на форзаці):
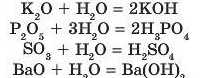
NiO + H0O — реакція не відбувається, бо оксиду NiO відповідає основа Ni(OH)2, яка є нерозчинною речовиною;
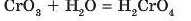
2. З лугом NaOH взаємодіють кислотні оксиди, тобто оксиди, утворені неметалічними або металічними елементами, валентність яких найчастіше дорівнює V, VI, УП:
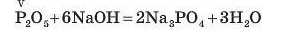
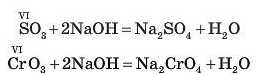
3. З кислотою HNO3 взаємодіють оксиди, утворені металічними елементами з низькими значеннями валентності (I, II, III):
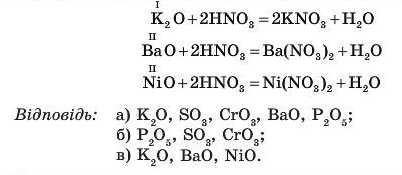
Запитання та завдання
1. Чи взаємодіють основні оксиди з кислотними?
Якщо взаємодіють, то які продукти реакції внаслідок цього утворюються?
2. Чи всі основні оксиди взаємодіють із водою? Як теоретично це можна розпізнати? Це явище лише хімічне чи також фізичне?
3. Чи взаємодіють основні оксиди з кислотами? Якщо взаємодіють, то які продукти реакції внаслідок цього утворюються?
° 4. Оксиди яких елементів найчастіше трапляються в природі? Які з них використовують для добування металів?
5. Кальцій оксид застосовують для відокремлення водяної пари, що міститься в повітрі. Яку властивість цього оксиду використовують? Відповідь підтвердьте рівнянням відповідної реакції.
6. Тримати в руках калій оксид не можна. Що відчуватимуть пальці, якщо порушити це правило? Відповідь підтвердьте рівнянням реакції.
* 7. Напишіть рівняння реакції між киснем O2 і: а) літієм;
б) бісмутом; в) нікелем, якщо відомі формули відповідних оксидів: Li2O, Bi0O3, NiO. Яку масу порошкоподібного біс-муту потрібно витратити, щоб одержати 23,3 г бісмут(НІ) оксиду?
* 8. Визначте, скільки молекул кисню O0 утвориться в разі
термічного розкладу 40 г хром(УІ) оксиду згідно з рівнянням реакції
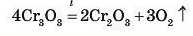
9. Які з наведених пар оксидів можуть взаємодіяти між собою за певних умов з утворенням солі: Ll2O + CrO3, BaO + SiO2, CaO + MnO, N2O5 + CO2, SO3 + MgO, P2O. + Na2O? Напишіть рівняння реакцій, якими це можна підтвердити.
10. Які з указаних оксидів: Na2O, CaO, CO2, N2O., FeO, SiO2 взаємодіють з: а) КОН; б) H2O; в) НС1? Напишіть рівняння реакцій.
iIl. Напишіть рівняння таких реакцій:
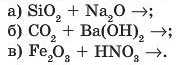
а) Скільки молів натрій оксиду прореагує?
б) Який об’єм (н. у.) карбои(ІУ) оксиду при цьому буде витрачено?
в) Скільки молекул HNO3 має вступити в реакцію, щоб утворилося 39,4 г солі?
12. У результаті пропускання повітря через розчин Ba(OH)2 з’явився осад. Який газ прореагував з основою Ba(OH)2? Яка речовина утворила осад? Напишіть рівняння реакції.
13. Як за допомогою дослідів за звичайних умов відрізнити два білих порошки: магній оксид і фосфор(У) оксид? Відповідь проілюструйте рівняннями реакцій.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:11, Переглядів: 3678