§ 23. Залежність радіусів атомів від періодичної зміни їхніх електронних структур
У цьому параграфі ви дізнаєтеся:
• що таке радіус атома;
• у яких одиницях виміру його визначають;
• як залежить ця величина від атомного (порядкового) номера елемента в періодичній системі.
Через те що електронна структура атомів хімічних елементів змішоється періодично зі зростанням заряду їхніх ядер, усі
характеристики, які визначаються електронною будовою, закономірно змінюються по періодах і групах періодичної системи. У цьому полягає фізична суть періодичного закону Д. І. Менделєєва.

До таких характеристик відносять, зокрема, радіус атома.
Відповідно до сучасних уявлень про будову атома ізольований атом не має точно визначеного розміру, оскільки електронна оболонка атома стає дуже розмитою вже на відстані кількох иа-нометрів від ядра.
Щоби підтвердити це, розглянемо стан електрона, який перебуває в просторі навколо ядра атома Гідрогену. Цей стан називають електронною хмарою, що має певпу густину негативного електричного заряду в певному об’ємі простору навколо ядра. Наглядне, хоча й умовне уявлення про електронну хмару надає рис. 23.
Електрон через безперервний рух із величезною швидкістю (близько 10° м/с) не може дотримуватися точно встановлених просторових меж. Унаслідок електростатичного притягання електрона до позитивно зарядженого ядра існують місця навколо ядра, де він перебуває найчастіше (тобто там, де його місцезнаходження найімовірніше; їх позначено точками з найбільшою густиною), і такі місця, де електрон перебуває дуже рідко.
Отже, стає очевидним, що визначити абсолютні розміри атомів практично неможливо. Можна говорити лише про радіуси атомів, які визначають за між’ядерними відстанями в кристалах або молекулах. Такі радіуси називають ефективними.
Ефективні радіуси перебувають у періодичній залежності від зарядів ядер і будови електронних оболонок атомів. Радіуси атомів мають максимальне значення в елементів, які стоять на початку періоду, а потім дещо зменшуються при переході зліва направо. Наприклад, в атомі Літію, з якого починається другий період, заряд ядра +3 і на зовнішньому енергетичному рівні міститься один електрон, а в атомі Неону, яким завершується цей період, заряд ядра +10 і вісім зовнішніх електронів. Зі збільшенням заряду ядра притягання електронів до нього зростає і радіуси атомів зменшуються: наприклад, радіус атома Літію дорівнює 0,159 пм, а радіус атома Неону — уже 0,036 им

(рис. 24). Отже, найменші радіуси мають атоми, якими завершуються періоди: відбувається немовби стиснення атомів.
Така закономірність у зміненні атомних радіусів пов’язана з послідовним збільшенням заряду ядра й відповідно числа електронів, а отже, і з більшою силою їхнього взаємного притягання. Це спричиняє спадання металічних властивостей елементів та простих речовин і зростання пеметалічних. Най-типовіші металічні елементи розташовані на початку періодів, а найтиповіші неметал Ічні — у кінці. Завершується кожний період інертним газом, атом якого має найменший радіус.
Радіус атома Натрію, з якого починається наступний, третій період, знову різко зростає. Збільшення радіусів атомів елементів третього періоду зумовлене тим, що в них починається заповнення нового енергетичного рівня.
Аналогічне різке зростання радіусів атомів спостерігається в усіх елементів, з яких починаються періоди, а саме: у Калію, Рубідію, Цезію, Францію (рис. 25). При цьому притягання
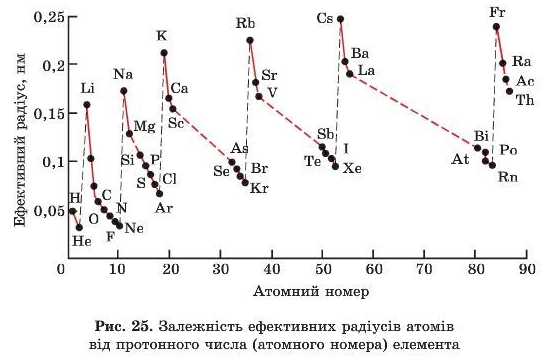
зовнішніх електронів до ядра зменшується. Через це металічні властивості елементів і простих речовин у головних підгрупах зі збільшенням порядкового номера (зверху вниз) зростають і найяскравіше виявляються в нижчого елемента підгрупи, а неметал Ічні — у верхнього.
Отже, розміри атомів визначаються зарядом ядра та будовою електронної оболонки. Тому зміна радіусів атомів зі збільшенням атомного номера (протонного числа) елемента має чітко виражений періодичний характер: у групах розміри атомів зростають, у періодах — зменшуються.
Запитання та завдання
1. У яких одиницях виміру визначають радіуси атомів? У скільки разів один нанометр менший за один метр?
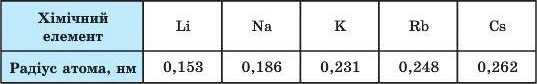
2. За значеннями радіусів атомів елементів головної підгрупи І групи побудуйте графіки залежності радіусів атомів від протонного числа елемента.
3. Як змінюється сила притягання зовнішніх електронів до ядра в періоді й у підгрупі?
4. Як змінюються розміри атомів у періодах? у групах перших трьох періодів періодичної системи елементів?
5. Чому в разі переходу від останнього елемента певного періоду до першого елемента наступного періоду радіуси атомів різко зростають?
6. Розташуйте елементи в порядку збільшення радіусів атомів: а) Сульфур, Телур, Селен, Полоній; б) Магній, Фосфор, Хлор, Алюміній; в) Магній, Кальцій, Цезій, Берилій;
г) Флуор, Хлор, Астат, Йод; ґ) Калій, Арсен, Кальцій, Бром.
7. Розташуйте за порядком зростання металічних властивостей символи таких елементів: а) Алюміній, Натрій, Магній; б) Кальцій, Барій, Стронцій.
8. Розташуйте за порядком зростання неметалічних властивостей символи таких елементів: а) Телур, Сульфур, Селен; б) Бром, Хлор, Флуор.
9. Який хімічний елемент четвертого періоду виявляє найбільші металічні властивості?
10. Який хімічний елемент головної підгрупи IV групи виявляє найбільші иеметалічні властивості?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:56, Переглядів: 5988