§ 19. Рух електронів в атомі. Орбіталі
У цьому параграфі ви дізнаєтеся:
• які унікальні властивості має електрон;
• що таке електронна хмара й атомна орбіталь;
• чим характеризуються атомні орбіталі.
Рух електронів в атомі пояснюють з позицій квантової, або хвильової, механіки. Згідно із цією теорією, постійно рухомий електрон завдяки надзвичайно малій масі (9,11 -10 31 кг) має унікальні властивості: вій водночас виявляє властивості частинки (має певні масу та заряд) і хвилі, тобто, як кажуть науковці, має двоїсту природу. Хвиля відрізняється від частинки тим.
що її положения на певний момент часу не можна точно визначити. Наведемо аналогію: коли ви говорите, то звук (звукові хвилі) чутно не в якійсь визначеній точці простору, а в усьому навколишньому просторі. Так само й електрон, який рухається навколо ядра з величезною швидкістю, начебто «розмазує» в просторі свій негативний заряд. Таким чином створюється немов електронна хмара нерівномірної густини, без чітких меж. Густина електронної хмари, або електронна густина, показує, у яких місцях електрон перебуває частіше за інші, а у яких — рідше.
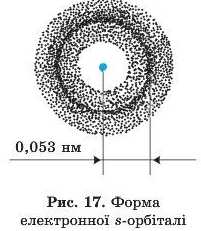
Електронні хмари окремих електронів у сумі створюють спільну електронну хмару атома.
Густина електронної хмари, створеної одним електроном атома Гідрогену, безпосередньо поблизу ядра практично дорівнює нулю. Зі зростанням відстані від ядра її густина електронної хмари збільшується й досягає максимального значення на відстані 0,053 нм , а потім знову зменшується. Таким чином, ту частину електронної хмари, у якій електрон перебуває найбільше часу, тобто в якій електронна густина достатньо велика, називають атомною орбіталлю (рис. 17). Для електрона в атомі Гідрогену це відстань 0,053 им від ядра.
Атомна орбіталь — це та частіша простору навколо ядра, де найімовірніше перебуває електрон.
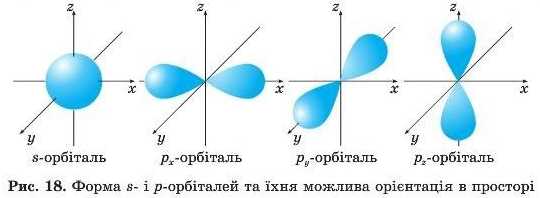
Атомні орбіталі мають певні форми, різні розміри та спрямованість у просторі (рис. 18). Орбіталі різної форми позначають малими буквами латинського алфавіту s, р, d, f тощо. s-Орбіталь має форму кулі, р-орбіталі — форму гантелі, або об’ємної вісімки.
1 нм (нанометр) = 1 • 10 9 м.
Вони орієнтовані в просторі по одній із трьох взаємно перпендикулярних координатних осей х, у, z. Ще складнішу форму мають d-орбіталі — це в більшості випадків схрещені вісімки, також по-різному орієнтовані в просторі.
Електрони, що рухаються орбіталями меншого розміру, сильніше притягуються до ядра, тобто мають більшу енергію електростатичної взаємодії з ним, ніж електрони, що рухаються орбіталями більшого розміру.
Запитання та завдання
1. Яка незвичайна властивість, притаманна електрону, відрізняє його від більших частинок?
2. Що називають: а) електронною хмарою; б) атомною орбіталлю?
3. На що вказує густина електронної хмари?
4. Що в сумі створюють електронні хмари окремих електронів?
5. Сильніше до ядра притягуються електрони, що рухаються орбіталями: а) меншого розміру; б) більшого розміру. Або в) сила притягання не залежить від розміру орбіта-лей.
6. Густина електронної хмари, створеної одним електроном атома Гідрогену, має найбільшу густину: а) безпосередньо біля ядра; б) на відстані 0,053 нм; в) на відстані, більшій за 0,053 нм.
7. Яку форму мають s- і р-орбіталі?
8. Чи орієнтована певним чином у просторі s-орбіталь?
9. Відомо, що позитивний заряд атома зосереджено в незначному об’ємі атомного простору — ядрі. Чи можна стверджувати, виходячи з електроиейтральності атома, що негативний заряд електрона зосереджено в такому самому або ще меншому об’ємі?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:53, Переглядів: 2901