§ 9. Стан електронів в атомі
Опрацювавши параграф, ви дізнаєтеся:
що електрон має властивості і частинки, і хвилі; що таке орбіталь.
У хімічних реакціях ядра атомів не змінюються. Що ж тоді відбувається? Чому речовини, які містять атоми одного і того ж еле-
мента, наприклад, натрій гідроксид та натрій хлорид, суттєво відрізняються за властивостями, але в той же час подібні до речовин, утворених атомами інших елементів: натрій гідроксид має подібні властивості із калій гідроксидом?
Учені встановили, що всі хімічні властивості речовин визначаються будовою електронних оболонок атомів.
Завдяки надзвичайно малій масі (приблизно в 1837 разів меншій, ніж маса протона і нейтрона), електрон має унікальні властивості — він одночасно виявляє властивості і частинки, і хвилі. Подібно до інших частинок, електрон має певну масу та заряд. У той же час, електрон, що рухається, виявляє хвильові властивості. Хвиля відрізняється від частинки тим, що її положення в просторі на даний час не можна точно визначити. Коли ви розмовляєте, то звук, що утворюється при цьому (звукові хвилі) чутно не в конкретній точці, а у всьому оточуючому вас просторі. Так і електрон перебуває не в одній визначеній точці, а утворює електронну хмару.
Електронні хмари, що утворені окремими електронами, утворюють загальну електронну хмару атома.
ІОрбіталь — це частина простору в атомі з найвірогіднішим перебуванням електрона.
Схематично орбіталь зображена на мал. 4.
Кожна орбіталь має певну форму. Якщо електрон створює електронну хмару такої самої форми, то вважають, що електрон міститься в даній орбіталі або займає орбіталь.
Орбіталі різної форми позначають буквами: Sy р, d і f s-орбіталі мають форму сфери, інакше кажучи, електрон, що міститься в такій орбіталі (його називають s-електроном), більшу частину часу проводить всередині сфери,
р-орбіталі мають форму об’ємної вісімки (мал. 5). Як видно з малюнка 5, р-орбіталі розміщені В просторі уздовж осей Xy у, Z, тому їх іще називають рх, р^ р.-орбіталями. Форми d- і f -орбіталей набагато складніші.
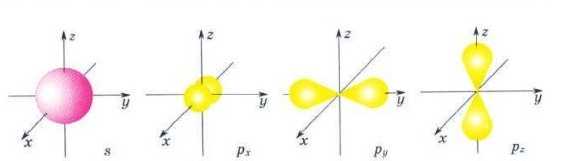
Мал. 5. Форма s- і р-орбіталей
Схематично орбіталь позначають квадратом 1.. .1.
Якщо в орбіталі немає електронів, то орбіталь вважають вільною. Електрон в орбіталі позначають стрілкою t . Один електрон в орбіталі називають неспареним.
Електрони в атомі мають певну енергію. В кожній орбіталі можуть розміститись два електрони, що мають однаков}' енергію, але протилежно направлені спіни: ІІ. (Спін електрона — обертання електрона навколо своєї осі. Один із двох електронів обертається за годинниковою стрілкою, інший — проти годинникової стрілки, тому ці електрони зображують у вигляді двох протилежно направлених стрілок).
Якщо в орбіталі містяться два електрони, то орбіталь називають заповненою, а електрони у ній — спареними.
— ВИСНОВКИ
Електрон має властивості і частинки, і хвилі.
Орбіталь — це частина простору в атомі, де найімовірніше перебування електрона
Орбіталі мають форму сфери, об’ємної вісімки та інші.
Орбіталь може бути вільною, містити один (неспарений) електрон або два (спарені) електрони.
Початковий рівень
1. Що таке орбіталь?
2. Яку форму мають орбіталі?
Середній рівень
3. Яка незвичайна властивість електрона відрізняє його від протона і нейтрона?
4. Яку орбіталь вважають: а) вільною; б) заповненою?
Достатній рівень
5. Що таке спін електрона?
6. Який електрон називають неспареним?
7. Як схематично зображують орбіталь?
Високий рівень
8. Зобразіть у зошитірх, р.-орбіталі.
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 21:58, Переглядів: 2375