§ 13. Характеристика хімічних елементів за їхнім місцем у періодичній системі та будовою атома
Опрацювавши параграф, ви дізнаєтеся:
як складати характеристику хімічного елемента за його місцем у періодичній системі.
Характеристику елемента складають за планом:
1. Порядковий номер, хімічний символ і назва хімічного елемента.
2. Номер періоду, підгрзчіа і група, у яких розміщено хімічний елемент.
3. Відносна атомна маса.
4. Склад атома (кількість протонів і нейтронів у ядрі атома). Кількість електронів.
5. Електронна формула атома. Кількість завершених енергетичних рівнів. Кількість валентних електронів.
6. Тип хімічного елемента за будовою зовнішнього енергетичного рівня (s~, ρ-, d-, /-елемент).
7. Тип хімічного елемента за хімічним характером простої речовини (металічний чи неметалічний елемент).
8. Максимальне і мінімальне значення валентності.
За місцем у періодичній системі можна охарактеризувати будь-який хімічний елемент.
Складемо характеристику металічного елемента на прикладі Магнію.
1. Хімічний символ Магнію Mg. Порядковий номер 12.
2. Магній міститься у 3 періоді, головній підгрупі II групи періодичної системи.
3. Відносна атомна маса Магнію Ar(Mg) = 24,305.
4. Ядро атома Магнію містить 12 протонів (Пригадайте, що число протонів в ядрі атома дорівнює порядковому номеру елемента в періодичній системі).
Число нейтронів у ядрі дорівнює різниці між нуклонним і протонним числом: 24 - 12 = 12.
В атомі Магнію 12 електронів.
5. Магній — елемент 3-го періоду, тому електрони в його атомі розміщуються на трьох енергетичних рівнях. Електронна формула Магнію: 12Mg ls22s22pe,3s2. В атомі Магнію перший і другий енергетичні рівні завершені. На зовнішньому енергетичному рівні є 2 валентні електрони.
6. Оскільки електрони зовнішнього електронного шару Магнію містяться в s-орбіталі, то Магній належить до s-елементів.
7. На зовнішньому енергетичному рівні атома Магнію є 2 електрони, тому магній належить до металічних елементів. Проста речовина магній — метал.
8. У сполуках Магній двовалентний.
Складемо характеристику неметалічного елемента на прикладі Сульфуру.
1. Хімічний символ Сульфуру S. Порядковий номер 16.
2. Сульфур міститься у 3 періоді, головній підгрупі VI групи періодичної системи.
3. Відносна атомна маса Сульфуру Ar(S) = 32,066.
4. Ядро атома Сульфуру містить 16 протонів.
5. Електронна формула Сульфуру: JfiS ls22s22p63sz3p4.
Електронна графічна формула
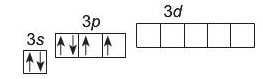
В атомі Сульфуру перший і другий енергетичні рівні завершені. В атомі Сульфуру є 6 валентних електронів.
6. Сульфур — р - елемент.
7. На зовнішньому енергетичному рівні атома Сульфуру є 6 електронів, тому він належить до неметалічних елементів. Проста речовина сірка — неметал.
8. Оскільки в атомі Сульфуру два неспарені електрони (основний стан атома), то мінімальне значення валентності дорівнює II.
У зв’язку із наявністю в атомі Сульфуру вільних cZ-орбіталей, існує можливість переходу одного електрона із Зр-орбіталі у Зс£-ор-біталь (перший збуджений стан атома):
S-*S*
ls22s22p63s23p4 ls22s22p63s23p33d1
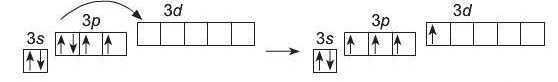
Кількість неспарених електронів збільшується із двох до чотирьох, тому Сульфур виявляє валентність IV
Також можливий перехід електрона із Зв-орбіталі у 3i/-op6i-таль (другий збуджений стан атома):
S* S**
ls22s22p63s23p33d1 ls22s22p£'ZslZp*M2
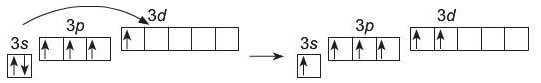
У другому збудженому стані атома кількість неспарених електронів 6, тому максимальна валентність Сульфуру дорівнює VI.
— ВИСНОВКИ
За місцем у періодичній системі складають електронну формулу атома хімічного елемента; визначають склад ядра атома; встановлюють тип хімічного елемента і утвореної ним простої речовини; визначають валентність і можливість перебування у збудженому стані.
Початковий рівень
1. У якому періоді розміщені такі елементи: Берилій, Силіцій, Бром, Аргентум?
2. У якій групі і підгрупі містяться елементи, символи яких Hg, Sr, Se, As?
3. Укажіть порядкові номери Оксигену, Кальцію, Купруму.
4. Яку відносну атомну мас}' мають Алюміній, Цинк, Фосфор?
Середній рівень
5. Наведіть два-три приклади хімічних елементів, які виявляють валентність V
6. Яку максимальну валентність у сполуках виявляють Карбон і Силіцій?
7. Скільки валентних електронів в атомах Натрію і Барію?
Достатній рівень
8. За планом, наведеним у параграфі, складіть характеристику: а) Літію; б) Фосфору. (Атом Фосфору може перебувати у збудженому стані).
9. Для яких елементів максимальне значення валентності не дорівнює номеру групи, у якій вони розміщені?
Високий рівень
10. За планом, наведеним у параграфі, складіть характеристик}' Хлору. У скількох збуджених станах може перебувати атом Хлору? Зобразіть їх за допомогою електронних графічних формул.
11. * Чим подібні Гідроген і Хлор?
12. * Чим відрізняються Гідроген і Калій?
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 22:04, Переглядів: 23483