§ 8. Стан електронів атомів
Опанувавши матеріал параграфа, ви зможете:
• знати, що електрони в атомі перебувають у постійному русі; поняття «атомна орбіталь», «електронна густина»; форми орбіталей та їх просторове розташування;
• розуміти поняття «спін», «антиііаралельиі спіни»;
• розрізняти S- і р-електрони; форми s- і р-орбіталей.
Подальше вивчення будови атома підтвердило те, що електрони в атомі перебувають у постійному русі. Однак ядерна (планетарна) модель будови атома виявилася недосконалою, оскільки не дала чітких уявлень про розподіл електронів у просторі, який утворюється навколо ядра атома, та їх рух. Окрім цього, під час обертання навколо ядра електрони мали б втрачати енергію та впасти па ядро, чого насправді не відбувається. Це CiiOHyKkL1IO дослідників будови атома до нових роздумів і наштовхнуло па думку про те, що електрон проявляє подвійну природу, зокрема, він налічений властивостями мікрочастинки та хвилі, як установив датський фізик-теоретик Нільс Бор. Отже, було зроблено висновок: фізичні закони про рух великих тіл не відповідають уявленням про рух електронів.
Стан електронів вагомі. Науковими дослідженнями встановлено, що електрон, рухаючись в атомі, не описує чітко виражену траєкторію, а утворює певний об’єм простору навколо ядра атомну орбіталь. Тому можна описати більшу чи меншу ймовірність (до 90 %) перебування його в цьому просторі.
Атомна орбіталь це об’єм простору навколо ядра атома, у якому найбільш імовірне перебування електрона.
Отже, електрон перебуває в певний проміжок часу на атомній орбіталі. Унаслідок того, що електрон, крім властивостей частинки, наділений і властивостями хвилі, одночасно визначити швидкість і напрямок його руху неможливо. Досліджено, що швидкий рух електрона навколо ядра спричиняє утворення
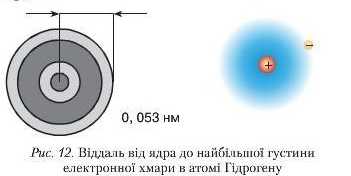
«електронної хмари» (уявіть собі рух прив'язаної до нитки кульки, яку швидко обертають). Ця хмара характеризується неявною густиною негативного заряду, що ніби розтягується в об’ємі руху електрона. Там, де ймовірність перебування електрона найбільша, густина хмари велика, але з віддаленням його від ядра атома густина цієї хмари швидко зменшується (рис. 12).
Поясніть, чому хмара, утворена рухом електрона, має негативний заряд.
Електронні хмари, що виникають унаслідок руху окремих електронів у атомі, у сумі утворюють електронну оболонку атома. З’ясовано, іцо під час хімічних реакцій ядра атомів не зазнають жодних змін. Змінюються електронні оболонки і, відповідно, властивості елементів. Тому, щоб зрозуміти та пізнати суть хімічного перетворення, погрібно знати про стан електронів в атомі.
Характеристика орбіталей. Утворену рухом електрона електронну хмару називають орбіталлю (відповідно сучасну модель будови атома називають орбітальною, або квантово-механічною). Орбіталі відрізняються за формою, тому електрони по-різному рухаються навколо ядра.
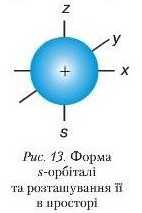
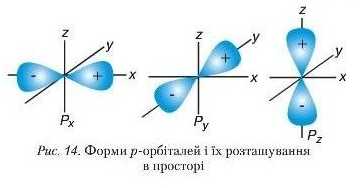
За сучасними відомостями про стан електронів в атомі, виокремлюють такі форми орбіталей: S- (читається «ес»), р- (читається — «пе»), сі- (читається «де»), /- (читається «еф»). s-Орбіталі(від англ. сфера) мають сферичну форму, тобто форму кулі. У її центрі розташовується ядро атома. Електрони сферичної форми називають s-електронами. р-Орбіталі(від ан/л. перпендикуляр) описують під час руху навколо ядра форму правильної вісімки (гантелі). Електрони з гантелеподібноіо орбіталлю називають р-електронами.
d- і J-Електрони рухаються навколо ядра, описуючи ще складніші конфігурації електронних хмар.
Оскільки ви вивчаєте будову електронних оболонок атомів хімічних елементів № 1 20, то для них властиві тільки л- і р-орбіталі.
Іншою, досить важливою характеристикою орбіталі, є запас вперш електрона. Запас енергії залежить від того, на якій віддалі від ядра рухається електрон. Найменший запас енергії має той електрон, який розташовується найближче до ядра атома. У міру віддалення від нього енергія електрона зростає. Віддаль від ядра, па якій найбільш ймовірне перебування електрона, називають енергетичним рівнем. Енергетичний рівень утворюють електрони» що характеризуються приблизно однаковою енергією. Синонімом до поняття «енергетичний рівень» є поняття «електронний шар». Енергетичний рівень, найбільш віддалений від ядра атома, називають зовнішнім.
Енергетичні рівні нумерують так: найближчий до ядра перший, йому ж відповідає найближча орбіталь. Другий рівень розташований на більшій віддалі від ядра, порівняно з першим, третій ще далі від другого і т. д. Тому для орбіталей з різним запасом енергії властиві різні розміри.
Схематично s~ і р-орбіталі можна зобразити так, як подано па рисунках 13 і 14.
Необхідно звернути увагу нате (рис. 14), що кожна орбіталь має певну просторову орієнтацію. Для р-орбіталей характерним є розташування в трьох взаємно перпендикулярних площинах.
Підсумовуючи скапане, можна стверджувати, що електрони під час руху характеризуються певною формою орбіталі, запасом енергії та відповідною орієнтацією в просторі. Однак ученими досліджено, що жоден із відомих атомів не має двох однакових електронів.
Пригадайте з курсу географії, що спостерігається під час обертання Землі навколо власної осі. Чи можна такі зміни назвати періодичними?
Отже, окрім того, що електрони рухаються навколо ядра, їм властиво рухатися навколо власної осі. Рух електрона навколо власної осі можна порівняти з рухом Землі навколо її осі.
Це ще одна характеристика електрона. Рух електрона навколо власної осі називають спіном (від атя. обертання).
Якщо ж два електрони обертаються навколо своєї осі в одному напрямку (наприклад, за годинниковою стрілкою), то їх називають електронами з паралельними спінами. Однак їх рух може відбуватися у взаємно протилежному напрямку (один рухається за годинниковою стрілкою, другий — проти). Тоді говорять про те, що ці електрони характеризуються антипаралельними спінами.
Кількість енергетичних ріпній в електронній оболонці атома визначають за номером періоду, у якому розташований елемент. Наприклад, Силіцій елемент 3 періоду, тому електрони розташовуються ііа трьох енергетичних рівнях.
Отже, можемо зробити висновок про те, що номер періоду — це фізична величина, яка вказує на кількість енергетичних рівнів в атомі.
Електрони характеризуються різним запасом енергії залежно від того, на скільки енергетичний рівень віддалений від атомного ядра. Чим ближче вони перебувають до ядра атома, тим запас їх енергії менший, і навпаки: у більш віддалених більший. Тому для орбіталей з різним запасом енергії властиві й різні розміри.
Під час хімічних перетворень за певних умов електрони здатні займати вищі енергетичні рівні, ніж ті, на яких вони перебували. Про це ви дізнаєтеся далі.
ПІДСУМОВУЄМО ВИВ НЕПЕ
• Науковими дослідженнями встановлено, що електрон характеризується подвійною природою — мікрочастинки та хвилі — й під час руху навколо ядра утворює атомну орбіталь.
• Атомна орбіталь — це об’єм простору навколо ядра атома, в якій найбільш імовірне перебування електрона. За сучасними даними про стан електронів в атомі, існують чотири форми орбі-талей: S-, р-, d-, f-. На одній орбіталі можуть перебувати тільки два електрони з антипаралельними спінами.
• Електрони рухаються не тільки навколо ядра, а й навколо власної осі. Рух електрона навколо власної осі називають спіном.
• Електрони, що мають однаковий запас енергії, утворюють енергетичний рівень.Кількість енергетичних рівнів в атомі визначають за номером періоду, в якому розташований елемент. Залежно від запасу енергії електронів, вони різняться розмірами.
• Стан електрона в атомі характеризується формою орбіталей та їх просторовим розташуванням, спіном, розмірами залежно від запасу енергії.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Назвіть, якими характеристиками описують стан електрона в атомі.
2. Назвіть орбіталі, що утворюють електрони під час їх руху навколо ядра атома. Чим вони відрізняються?
3. Сформулюйте визначення: а) атомної орбіталі; б) понять «спін», «енергетичний рівень».
4. Поясніть, як ви розумієте поняття «паралельні спіни», «антипа-ралельні спіни».
5. Охарактеризуйте форми s- і р-орбіталей та їх розташування в просторі.
6. Обґрунтуйте, чи можуть електрони різних енергетичних рівнів характеризуватися однаковим запасом енергії.
7. Обґрунтуйте відмінність сучасних уявлень про модель будови атома від тих, які існували раніше, зокрема про планетарну.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 18-09-2016, 23:47, Переглядів: 2572