Електронна будова атомів
Матеріал параграфа допоможе вам:
• зрозуміти, що електронна будова атома відповідає його стану з найменшою енергією;
• складати електронні формули атомів;
• прогнозувати можливі значення валентності елементів.
Розміщення електронів в атомах. Усе в навколишньому світі прагне перейти у стан із найменшою енергією. Такий стан є найстійкішим і тому найвигіднішим. Принцип найменшої енергії визначає й електронну будову атома.
Електрони в атомі розміщуються так, щоб їхня енергія була мінімальною.
Розглянемо, як заповнюють електрони енергетичні рівні та підрівні в атомах різних елементів.
Атом елемента № 1 Гідрогену містить лише один електрон. Згідно із принципом найменшої енергії цей електрон має перебувати якомога ближче до ядра, тобто належати першому енергетичному рівню і займати ls-орбіталь.
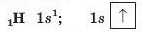
Електронна формула атома Гідрогену4 та її графічний варіант такі:
Атом елемента № 2 Гелію містить два електрони. Чи може другий електрон надійти на перший енергетичний рівень? Так, бо максимальна «ємність» першого рівня — 2 електрони. Ці частинки перебуватимуть в одній орбіталі й матимуть різні спіни.
В атомі елемента M1 3 Літію — 3 електрони. Два електрони займають ls-орбіталь; перший енергетичний рівень заповнюється, і третій електрон надходить на другий рівень (схема 2). Із 2s- і 2р-орбіталей він «обирає» ту, яка має нижчу енергію, тобто 2в-орбіталь.
Запишемо електронну формулу атома Гелію та її графічний варіант:
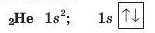
Електронна формула атома Літію та її графічний варіант такі:
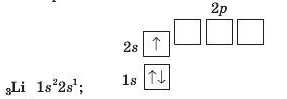
Електрони на останньому енергетичному рівні атома називають зовнішніми. В атомі елемента Літію — один зовнішній електрон; він перебуває у 2в-орбіталі.
Щоб виділити в атомі зовнішні електрони, використовують скорочений запис електронної формули. Для атома Літію він є таким: [HeJ2s1. Символ елемента Гелію у квадратних дужках означає, що внутрішня електронна оболонка атома Літію така сама, як і електронна оболонка атома Гелію (Is2). Скорочені записи електронних формул атомів містяться в короткому варіанті періодичної системи (форзац І, мал. 19).

Іноді електронні формули атомів записують, зазначаючи лише зовнішні електрони. Така формула для атома Літію — ...2s1.
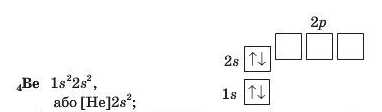
В атомі елемента № 4 Берилію — 4 електрони. Четвертий електрон «складає пару» третьому й розміщується у 2я-орбіталі:
Цікаво знати
Електронну будову атомів елементів, відкритих останнім часом, остаточно не з’ясовано.
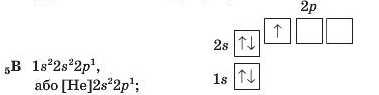
Атом елемента № 5 Бору має 5 електронів. П’ятий електрон належить другому енергетичному рівню і займає одну з р-орбіталей:
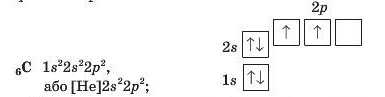
В атомі елемента № о Карбону з являється шостий електрон. Він може або «підселитися» до п’ятого електрона в р-орбіталь, або зайняти вільну р-орбіталь. Реалізується друга можливість: електрони, маючи однойменні заряди, відштовхуються один від одного; їм вигідніше перебувати в різних орбіталях.
Електронна формула атома Карбону та її графічний варіант:
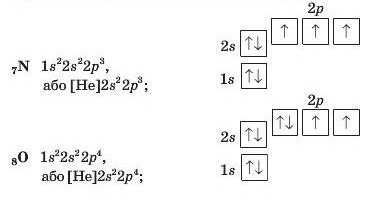
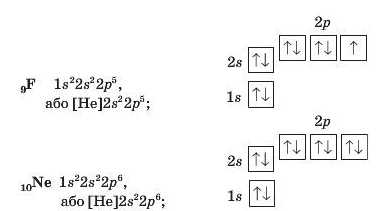
Ураховуючи те, що кожний електрон намагається зайняти порожню орбіталь останнього підрівня, а в разі її відсутності «підселяється» до іншого електрона (ці електрони матимуть протилежні спіни), запишемо електронні формули атомів решти елементів 2-го періоду:
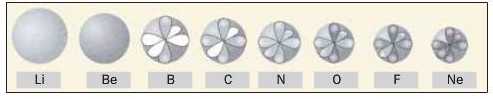
Атоми елементів 2-го періоду з орбіталями зовнішнього енергетичного рівня зображено на малюнку 20 (напівзаповнені орбіталі — світло-сірі, повністю заповнені — темно-сірі).
Мал. 20. Атоми елементів 2-го періоду
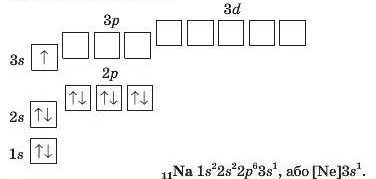
В атомі елемента № 11 Натрію починається заповнення третього енергетичного рівня. На ньому з’являється один електрон, який розміщується в Зя-орбіталі:
► Виведіть електронні формули атомів решти елементів 3-го періоду.
Зверніть JrrBary: кількість енергетичних рівнів атома, на яких перебувають електрони, збігається з номером періоду, де міститься елемент. Це підтверджує схема 2 (с. 35).
Тепер складемо електронну формулу атома Калію (елемент № 19), який започатковує 4-й період:
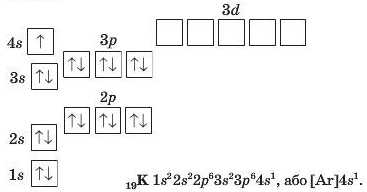
В атомі наступного елемента Кальцію 20-й електрон також розміщується в 4а-орбіталі, маючи протилежний спін.
► Запишіть електронну формулу атома Кальцію.
Ви бачите, що в кожному атомі немає електронів з однаковими характеристиками. Вони розміщуються або в різних орбіталях, або в одній, але з різними спінами.
При складанні електронних формул атомів інших елементів 4-го періоду потрібно враховувати, що енергія електронів на підрівнях зростає в такому порядку (схема 2):
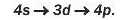
В атомах Хрому і Купруму послідовність заповнення орбіталей дещо порушується: один електрон переходить із 4s-op6irani в 3d-op6i-таль (форзац І).
Зовнішні електрони атома і валентність елемента. Атом Гідрогену має єдиний електрон. Значення ватентності цього елемента дорівнює I. На другому (останньому) енергетичному рівні атома Літію перебуває один електрон, а атома Флуору — сім електронів, серед яких один є не-спареним. Літій і Флуор — одновалентні елементи. Атом двовалентного Оксигену містить два неспарені зовнішні електрони, а в атомі
Нітрогену, який може бути тривалентним, таких електронів — три.
Кількість неспарених електронів в атомі вказує на можливе значення валентності елемента.
Згодом ви дізнаєтесь про те, як прогнозувати інші значення валентності елементів з урахуванням наявності вакантних орбіталей в атомах.
Електрони в атомі розміщуються так, щоб їхня енергія була мінімальною.
Електронні формули атомів складають, урахо-• · ·■· · вуючн послідовність зростання енергії електронів
у різних орбіталях. Кожний енергетичний рівень заповнюють електронами, починаючи із s-орбіта-лі. Шсля цього заповнюють р-орбіталі, поміщаючи в кожну з них спочатку по одному електрону.
Кількість енергетичних рівнів з електронами, що має атом, збігається з номером періоду, в якому міститься елемент.
Кількість неспарених електронів в атомі вказує на можливе значення валентності елемента.
46. Атом елемента 2-го періоду на останньому енергетичному рівні має 6 електронів. Скільки серед них спарених електронів, а скільки — неспарених?
47. Атоми яких елементів 2-го періоду мають один неспарений електрон, два неспарені електрони?

48. Назвіть елемент, атом якого має таку електронну формулу:
49. Назвіть два елементи, в атомах яких кількість усіх S- і всіх р-елек-тронів однакова.
50. Яке значення валентності може мати елемент, якщо його атом має електронну формулу:
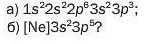
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:42, Переглядів: 17638