§ 10. Стан електронів у атомі
Опрацювавши зміст параграфа, ви будете:
• мати уявлення про рух електронів у атомі; спін електрона;
• розуміти суть понять «орбіталь», «електрона густина»;
• уміти схематично позначати орбіталь з двома електронами, що мають протилежні спіни; характеризувати s і р - орбіталі.
Відомо, що в атомі будь-якого елемента електрони рухаються. Вони не можуть бути нерухомими, бо під дією сили притягання до позитивно зарядженого ядра впали 6 на ядро. Але електрони не обертаються навколо ядра, як вважали раніше (згадайте планетарну (ядерну) модель атома Е. Резерфорда, § 8). Як же вони рухаються в атомі?
Щоб зрозуміти стан електрона в атомі, треба взяти до уваги подвійну природу електрона і той факт, що світ атома - це мікросвіт. Він не підкоряється законам, вияв яких ми звикли спостерігати в житті, тобто в умовах макросвіту. Рух електрона в атомі неможливо описати певною траєкторією (неперервною лінією, яку описує матеріальна точка як тіло під час руху). Можна говорити лише про більшу чи меншу ймовірність перебування електрона в обмеженому об’ємі простору біля ядра (можлива й нульова ймовірність). Рухаючись в атомі, електрон займає тривимірну ділянку простору біля ядра, що називається атомною орбіталлю.
Ділянка простору поблизу ядра, в якій найімовірніше перебування електрона, називається орбіталлю.
Зрозуміло, що чітко визначити межі орбіталі неможливо, вони розпливчасті. Електрон заповнює простір поблизу ядра у формі хвилі, яку можна уявити як «електронну хмару». Негативний заряд електрона виявляється «розмазаним» в усьому об’ємі простору біля ядра, яке оточене тривимірною електронною хмарою. І густина неоднакова в різних місцях. У тих місцях, куди електрон потрапляє найчастіше, утворюється зона найбільшої електронної густини. У міру віддалення від ядра електронна густина дуже швидко зменшується й стає такою малою, що нею можна знехтувати.
Окрім руху біля ядра, електрон має ще свій власний рух - спін. Спрощено спін (від англ. Spin - обертання) можна уявити як рух електрона навколо власної осі. Якщо два електрони мають однакові напрямки обертання, то говорять, що це електрони з паралельними спінами, а якщо напрями обертання у них протилежні (один електрон обертається навколо власної осі за годинниковою стрілкою, а інший - проти годинникової стрілки), то це елек-
------- - __ -------- ^^ЧІЧІ Ii I --W
трони з антипаралельними спінами. Два електрони з протилежними спінами створюють навколо себе магнітне поле з протилежно спрямованими силовими лініями, що забезпечує умови для взаємного притягання електронів.
На одній орбіталі може перебувати лише два електрони, які мають протилежні спіни. Схематично атомну орбіталь позначають так:
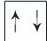
де квадрат (комірка) - це орбіталь, а стрілки - електрони з протилежними спінами. Одноєлектронна орбіталь зображується так:

Характеристика орбіталей. Якщо йдеться про ту частину електронної хмари (орбіталі), де її густина найбільша, то можна говорити про її розмір і форму. Так, залежно від величини енергії електронні хмари розрізняються за розмірами. Чим сильніше притягається електрон до ядра, тим його електронна хмара (орбіталь) менша за розміром, але щільніша (електронна густина більша).
Орбіталі (електроні хмари) розрізняються не лише за розмірами, а й за формою. Так, єдиний електрон в атомі Гідрогену, рухаючись біля ядра, утворює електронну хмару сферичної форми (форма кулі). Такі орбіталі позначають буквою s, а електрони, орбіталі яких мають сферичну форму, називають 5-електронами (мал. 5).
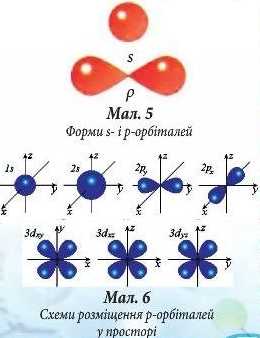
Проте орбіталі можуть мати й іншу форму, наприклад, гантелі (об’ємної «вісімки») або ще складнішу. Такі орбіталі позначають буквою р, а електрони, орбіталі яких мають гантелеподібну форму, називають р-електронами (мал.5).
р-Орбіталі відрізняються одна від одної розміщенням у просторі: вони розташовуються вздовж трьох взаємно перпендикулярних осей координат (мал. 6).
Орбіталі складніших форм позначаються буквами <і,/та ін.
Орбіталі різних форм відрізняються між собою також силою притягання до ядра. s-Електрони, орбіталі яких мають сферичну форму, притягуються до ядра сильніше, ніж р-електрони, орбіталі яких мають форму гантелі. А електрони з іще складнішими формами орбіталей притягуються ще слабкіше.
Висновки
Електрони в атомі перебувають у постійному русі, але вони не обертаються навколо ядра, як планети навколо Сонця.
Простежити шлях, по якому рухається електрон, неможливо, бо в нього немає траєкторії руху.
Електрон займає тривимірну ділянку простору біля ядра, в якій його перебування найімовірніше. Таку ділянку простору прийнято називати ор-біталлю.
Орбіталі бувають різної форми - 5-, р-, d-, /- орбіталі. Орбіталі, що мають сферичну форму, називаються s-орбіталями. р-Орбіталі мають ганте-лебодібну форму. Вони взаємно перпендикулярно орієнтовані у просторі вздовж осей X, у, Z рх, ру, pz.
Найсильніше притягаються до ядра s-орбіталі, р-орбіталі слабкіше і т. д.
На одній орбіталі може перебувати не більше двох електронів.
Завдання для самоконтролю
1. Як ви уявляєте рух електрона в атомі хімічного елемента? Відповідь обґрунтуйте.
2. Яку форму має: а) s-орбіталь; р-орбіталь? Намалюйте їх моделі.
3. Накресліть три осі ординат і намалюйте вздовж них три р-орбіталі.
4. Виліпіть із пластиліну модель s-орбіталі. За допомоги сірників зобразь-те її розміщення відносно осей координат. Так само виготуйте моделі р-ор-біталей і розмістіть їх у просторі одну відносно одної.
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:12, Переглядів: 1799