§ 21. Енергетичні рівні й підрівні

У цьому параграфі ви дізнаєтеся:
• що токе енергетичний рівень;
• яке максимальне число електронів може міститися на них;
• у якому стані може перебувати атом.
Енергетичні рівні. Електрони, які рухаються па орбіталях з приблизно однаковою енергією електростатичної взаємодії з ядром, утворюють електронні шари, або енергетичні рівні. Останні позначають буквою п і нумерують у порядку віддалення від ядра: п = 1, п = 2, п = 3, п = 4, п = 5, л = 6, п = 1 (рис. 19), або іменують відповідно великими буквами латинського алфавіту К, L, М, N, О, Р, Q. Значень від 1 до 7 число п набуває, коли атом перебуває в так званому основному (нор-мальному) стані.
Число п, яке може набувати тільки цілочислових значень, позначає номер енергетичного рівня.
Його називають головним квантовим числом.
Електрони першого рівня иай-міцпіше, порівняно з іншими, притягуються до ядра. Через це в них менший запас тієї енергії, яка дала б їм можливість відірватися від ядра, наприклад, у результаті дії па атом високих температур, випромінювання тощо, завдяки чому атом переходить у збуджений стан. У такому разі число п набуває значень від 1 до нескінченності.
Електрони наступних енергетичних рівнів слабкіше зв’язані з ядром. Вони мають більший запас енергії, тому що менше витрачають її на електростатичну взаємодію з ядром. Таким чином, можна зробити висновок: якщо в даному атомі електрони розподіляються но кількох енергетичних рівнях, то найслабкіший зв'язок з ядром мають електрони зовнішнього енергетичного рівня.

Число енергетичних рівнів в атомі, що заповнюються електронами, збігається з номером періоду, у якому розташований елемент. Так, в елементів першого періоду електронами заповнюється тільки один енергетичний рівень, другого періоду — два, третього періоду — три і так далі. Максимальне число електронів Ni що можуть перебувати на будь-якому енергетичному рівні атома, обчислюють за формулою
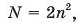
де п — помер рівня (починаючи від ядра), або головне квантове число.
Відповідно до цієї формули на першому від ядра енергетичному рівні може перебувати не більше двох електронів (2 • I2 = 2), на другому — не більше восьми (2-2 = 8), на третьому — не більше 18 (2 • З2 = 18), на четвертому — не більше 32 (2 • 42 = 32). Понад 32 електрони на жодному енергетичному рівні не виявлено.
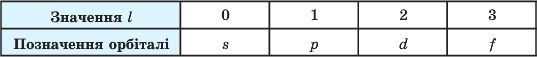
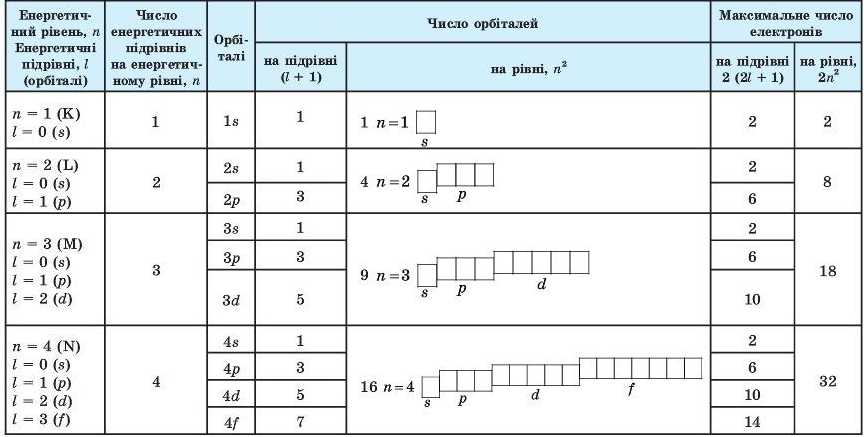
Енергетичні підрівиі й орбіталі. Починаючи зі значення головного квантового числа п = 2, енергетичні рівні (електронні шари) поділяють на підрівиі, які відрізняються один від одного енергією зв’язку з ядром (рис. 20). Число підрівнів дорівнює значенню головного квантового числа: перший рівень має один підрівень, другий — два, третій — три, четвертий — чотири і таїс далі. їхню форму визначає орбітальне(побічне, або азимутальне) квантове число І. Для кожного п це число може набувати тільки цілочислових значень від 0 до (п - 1).
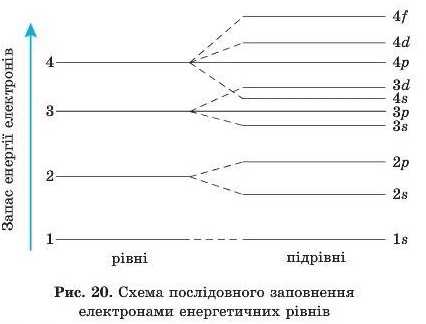
Підрівняй, у свою чергу, відповідають орбіталі. їх прийнято позначати малими літерами латинського алфавіту. Якщо Z = 0, то орбіталь, незалежно від значення головного квантового числа п, має сферичну форму, її називають s-орбіталлю. Значенню Z=I відповідає орбіталь, що має форму гантелі, — р-орбіталь. Зі збільшенням значення Z форма орбіталі ускладнюється. Залежно від значення орбітального квантового числа орбіталі позначають так:
Орбіталі, які характеризуються однаковим значенням п і різним значенням Z, мають різну енергію. Тому поряд з поняттям «енергетичний рівень» існує поняття «енергетичний підрівень» як сукупність орбіталей із певними значеннями головного та побічного квантових чисел.
На кожній орбіталі, відповідно до принципу Паулі (принципу заборони), можуть розміщуватися не більш як два електрони, що мають однакову енергію, але обов'язково відрізняються особливою властивістю — протилежним напрямком обертання навколо власної осі. Ця властивість отримала назву спін (від англійського spin, що означає «веретено»). Спінове обертання електрона може бути за годинниковою стрілкою та проти неї.
У табл. 8 показано, як число підрівнів, тип і число орбіталей та максимально можливе число електронів на енергетичному підрівні та рівні залежить від головного квантового числа.
Отже, для характеристики електронів в атомі необхідно знати номер енергетичного рівня п і типи орбіталей. Також важливо знати форму різних орбіталей (електронних хмар) у разі вивчення структури молекул.
Якщо електрон створює електронну хмару даної форми, то кажуть, що електрон «перебуває на даній орбіталі», або «займає дану орбіталь». Із цієї точки зору, орбіталь можна розглядати як «хатинку» для електрона. Якщо електрон перебуває на орбіталі, то кажуть, що вона зайнята, якщо ні — що вільна.
На другому енергетичному рівні (п = 2), як це видно з табл. 8, число орбіталей уже дорівнює чотирьом. Одна з них має сферичну форму. Її називають 2з-орбіталлю. 2з-Електроп, що перебуває на цій орбіталі, має більшу енергію, ніж ls-електрои, розміщений на s-орбіталі першого рівня, бо вій розташований на більшій відстані від ядра.
Інші три орбіталі — це 2р-орбіталі. Усі вони мають однакову геометричну форму, що нагадує форму гантелі або об’ємної вісімки (рис. 18). Але вони по-різному орієнтовані в атомному просторі — уздовж координатних осей X, у, 2. Через це р-орбіталі позначають ріЧ ру і рг. Якщо електрон розташований на рг-орбіталі, то це означає, що з найбільшою ймовірністю рг-електрон рухатиметься вздовж осі х. Відповідно, електрон на р^-орбіталі рухається вздовж осі у, а електрон на р,-орбіталі — уздовж осі 2. Зі зростанням числа п електрони займають р-орбіталі, які розташовані на більшій відстані від ядра, але иапрямленість їхнього руху вздовж осей х, р, г завжди зберігається.
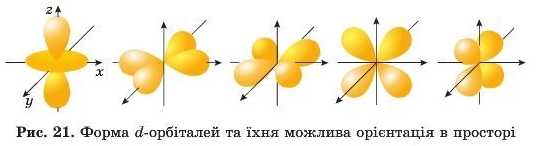
Форми d-орбіталей (їх п’ять) і /-орбіталей (їх сім) значно складніші (рис. 21). Атомні орбіталі таких складних форм в атомах з великим зарядом ядра менш енергетично вигідні для перебування електронів. Тому заповнюються ними лише тоді, коли S-, а потім р-орбіталі енергетичного рівня вже зайняті.
Графічно орбіталь прийнято зображати у вигляді квадрата, який ще називають квантовою коміркою, а електрони — у вигляді стрілок, спрямованих угору чи вниз.
Стрілки, спрямовані в протилежних напрямках, позначають електрони з протилежними (антипаралельними) спінами:
 |
— вільна орбіталь; |
 |
— орбіталь, на якій перебуває один електрон; |
 |
— заповнена орбіталь, на якій перебувають два електрони з протилежними спінами. |
Запитання та завдання
1. Що розуміють під енергетичними рівнями? Як їх позначають?
2. На що вказує головне квантове число? Яких значень воно набуває?
3. Електрони якого енергетичного рівня найслабкіше притягуються до ядра? Який у них запас енергії — найменший чи найбільший?
4. Якого значення може набувати головне квантове число для атома: а) у нормальному стані; б) у збудженому стані?
5. Скільки енергетичних рівнів заповнюється електронами в елементів: а) першого періоду; б) другого періоду; в) третього періоду? Наведіть приклади.
6. Яким є максимальне число електронів, що можуть перебувати на другому та третьому енергетичних рівнях? За якою формулою обчислюють максимальне число електронів?
7. Чим відрізняються один від одного s-електрони першого та другого енергетичних рівнів? Що в них є спільного?
8. Починаючи з якого енергетичного рівня, електрони розподіляються по підрівнях? Скільки підрівнів має: а) другий енергетичний рівень; б) третій енергетичний рівень; в) четвертий енергетичний рівень?
9. Яке квантове число характеризує енергію підрівнів? Якою буквою його позначають? Яких значень воно набуває для кожного значення головного квантового числа п?
10. Як заведено позначати орбіталі кожного підрівня? Наведіть приклади.
11. Чи різняться за енергією електрони, що перебувають на одній і тій самій орбіталі? Скільки електронів можуть розміститися на одній орбіталі? Чим вони мають обов’язково відрізнятися один від одного?
12. У чому полягає сутність принципу Паулі?
13. Як графічно заведено зображати: а) орбіталі; б) електрони з різними спінами;
14. Скільки всього орбіталей в атомі Сульфуру?
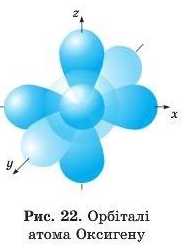
15. На рис. 22 зображено орбіталі атома Оксигену. Знайдіть Is-, 2s-, 2р-орбіталі. Зробіть рисунок у зошиті та підпишіть кожну орбіталь.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:54, Переглядів: 3735