§ 12. Структура електронної оболонки атома

В електронних оболонках атомів орбіталі існують не хаотично. Вони утворюють чіткі структури, що різняться числом і типом орбіталей.
Структуру орбіталей в атомі можна порівняти з багатоповерховим будинком, в якому окремі кімнати — це орбіталі. Кожний поверх — це енергетичний рівень, або енергетичний шар.
Енергетичний рівень об’єднує певне число орбіталей, що мають приблизно однакову енергію (мал. 12.1).
Кожний енергетичний рівень позначають числом η(п = 1, 2,
З, ...) або великою латинською літерою (К, L, M і далі за алфавітом).
Для першого (найближчого до ядра) рівня п = 1 (рівень К), для другого п = 2 (рівень L), для третього п = 3 (рівень М) тощо. Шарувату будову електронної оболонки атомів можна зобразити так: окружністю позначене ядро, що має певний заряд, а дугами — енергетичні рівні:
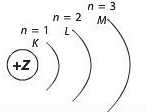
Кожний рівень з номером п містить п2 орбіталей.
Отже, перший енергетичний рівень складається з однієї орбіталі, другий — із чотирьох, третій — з дев’яти тощо.
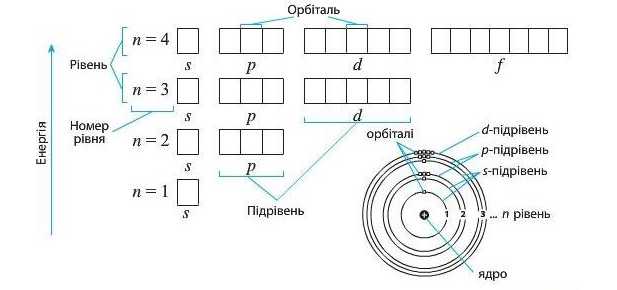
У багатоповерховому будинку кожний поверх розділяють на різні квартири. Але наш будинок незвичайний. Число квартир на кожному поверсі дорівнює номеру поверху, тобто на першому поверсі одна квартира, на другому' — дві тощо. Так само і в електронній оболонці, кожний енергетичний рівень складається з енергетичних підрівнів.
Число енергетичних підрівнів на енергетичному рівні дорівнює
номеру цього рівня.
Енергетичні підрівні позначаються так само, як і орбіталі. Тобто:

Зазвичай квартири в будинках розділяють на кімнати. У нашому випадку кімнати — це орбіталі.
Кожний енергетичний підрівень може містити тільки певне число орбіталей, що відповідає його типу:

Отже, можна перелічити орбіталі, з яких складають енергетичні рівні та підрівні v такий спосіб (для перших трьох рівнів):
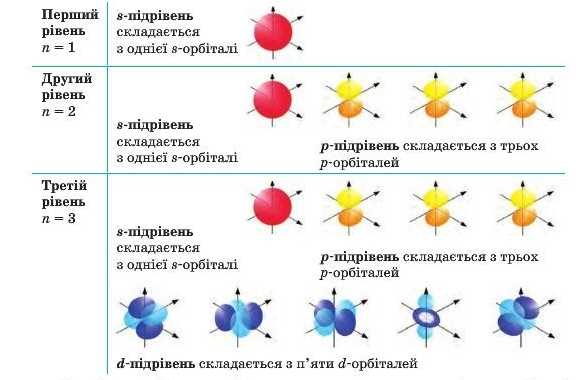
Графічно орбіталь прийнято позначати квадратом. Отже, орбіталі перших чотирьох енергетичних рівнів будуть виглядати так:
Як ми бачимо, перший енергетичний рівень складається з одного s-підрівня, утвореного однією s-орбіталлю. Другий рівень складається з двох підрівнів (s та р), утворених однією s-орбіталлю і трьома р-орбіталями (усього чотири). Третій рівень складається з трьох підрівнів (s, р, та d), утворених однією s-орбіталлю, трьома р-орбіталями і п’ятьма d-орбіталями (усього дев’ять). На четвертому рівні додається ще сім /-орбіталей і всього четвертий рівень складається з 16 орбіталей. Отже, загальне число орбіталей на рівні п відповідає кількості п2.
Зверніть увагу, що на схемі нумерація енергетичних рівнів при графічному зображенні відбувається знизу вгору. У такий спосіб підкреслюють, що знизу вгору збільшується енергія енергетичних рівнів. Отже, перший енергетичний рівень є найближчим до ядра і найнижчим за енергією. Електрони, що на ньому перебувають, мають найменшу енергію. Чим вище розташований енергетичний рівень, тим далі від ядра він перебуває і тим більшу енергію матимуть електрони.
Отже, електронні оболонки атомів мають досить складну, але чітку структуру з енергетичних рівнів, підрівнів та орбіталей. Як вони заповнюються електронами, ви дізнаєтеся в наступному параграфі.
В атомі орбіталі розташовуються таким чином, що ядро атома співпадає із центром кожної орбіталі. Якщо підрівень склада-I ється з декількох орбіталей, то вони розташовуються так, щоб і
бути максимально віддаленими одна від одної. Наприклад, три р-орбіталі будуть розташовані уздовж взаємно перпендикулярних осей із центром в ядрі атома.
При графічному зображенні орбіталей електронної оболонки атомів на і п'ятому енергетичному рівні необхідно додавати g-орбіталі, але в жодному хімічному елементі вони не заповнюються електронами, тому структуру орбіталей енергетичних рівнів, починаючи із четвертого зображують, однаково такими, що складаються із чотирьох підрівнів.
Позначення енергетичних підрівнів (s, р, d, f) жодним чином не пов'язано з формою орбіталей. Назви підрівням давали вчені, які вивчали випромінювання атомів із цих орбіталей. Вони назвали їх за формою смуг випромінювання: sharp — виразна, principal — головна, diffuse — розмита, дифузна, fundamental — основна. А коли відкрили наступний підрівень, його просто позначили наступною буквою після f, тобто д.
Висновки
Орбіталі утворюють енергетичні рівні. Кожний енергетичний рівень складається з енергетичних підрівнів, що у свою чергу складаються з певного числа орбіталей.
Контрольні запитання
1. Які енергетичні підрівні є на першому, другому та третьому енергетичних рівнях?
2. Зі скількох орбіталей складається кожен з відомих вам енергетичних підрівнів?
Завдання для засвоєння матеріалу
1. Як ви уявляєте собі просторове розташування однієї s-орбіталі та трьох р-орбіталей в атомі? Зобразіть це на малюнку, за початок координат прийміть центр атомного ядра.
2. Як ви вважаєте, чому атомні орбіталі мають саме таку форму? Чим це зумовлено?
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:48, Переглядів: 3681