§ 13. Розподіл електронів в електронній оболонці атомів
Пригадайте, як визначити склад атомів (за § 9) та структуру електронної оболонки атома (за § 12).
Місткість орбіталей
Електрони розподіляються по орбіталях за певними правилами. Першим розглянемо правило, яке визначає число електронів, що може містити одна орбіталь: на кожній орбіталі максимально можуть розміститися два електрони, що мають однакову енергію, але які відрізняються особливою властивістю — спіном.
Спін електрона — це його внутрішня властивість, що характеризує відношення електрона до магнітного поля. Наочно цю властивість
можна уявити як можливість обертання електрона навколо своєї осі. Якщо два електрони обертаються навколо власної осі в одному напрямку, то говорять, що їхні спіни паралельні, а якщо в різних напрямках — то їхні спіни антипара-лельні (мал. 13.1).

Отже, одна орбіталь може містити лише такі два електрони, спіни яких є антипаралельними. Це правило називають принципом заборони Паулі:
На одній орбіталі можуть перебувати не більше, ніж два електрони, причому їхні спіни мають бути антипаралельними.
Графічно орбіталь зображують у вигляді квадрата, а електрони — у вигляді стрічок, спрямованих догори або донизу, що наочно показує напрямок спіну електрона. Стрілки, спрямовані в протилежні боки, позначають електрони із протилежними спінами:
] — вільна (вакантна або незаповнена) орбітачь;
[] — орбітачь, що містить один електрон; такий електрон називають неспаренпм;

Австрійський та швейцарський фізик, лауреат Нобелівської премії з фізики 1945 р. Народився у Відні в родині відомого фізика й біохіміка. Ще школярем прочитав роботу Альберта Ейнштейна про теорію відносності. У 20 років написав оглядову статтю про загальну та спеціальну теорію відносності, яку навіть схвалив Ейнштейн. Після закінчення Мюнхенського університету працював асистентом у Нільса Бора.
Висловив припущення, що електронам притаманна властивість, яку пізніше назвали спіном. Сформулював закон, який сьогодні відомий як принцип заборони Паулі, що є фундаментальним для розуміння будови і поведінки атомів, атомних ядер, властивостей металів та інших фізичних явищ. Завдяки його особистісним якостям і схильності до нещадного критичного аналізу колеги називали його «докором фізики».
ш — заповнена орбіталь, що містить два електрони з протилежними спінами; такі електрони називають спареними або електронною парою.
Принцип найменшої енергії
Усі хімічні властивості речовин визначаються будовою електронних оболонок атомів. Для того щоб описати електронну будову певного атома, необхідно знати, як саме розподілені електрони по його орбіталях. Давайте розглянемо, як електрони заповнюють електронні орбіталі атомів.
Електрони займають орбіталі послідовно, починаючи з першого енергетичного рівня, у порядку збільшення енергії рівня.
Спочатку «заселяється» перший енергетичний рівень, потім — другий, третій тощо. Цей принцип називають принципом найменшої енергії.
Число енергетичних рівнів, що заповнюються в атомі певного елемента, визначають за номером періоду Періодичної системи, у якому розташований цей хімічний елемент.
Так, в атомах хімічних елементів першого періоду заповнюється тільки перший енергетичний рівень, в атомах елементів другого періоду — перші два енергетичні рівні, третього — три тощо.
Наприклад, Гідроген розташований у першому періоді під номером 1. Це означає, що в електронній оболонці його атомів міститься тільки один електрон, який перебуває на першому енергетичному рівні на єдиній s-орбіталі. Графічно будову електронної оболонки атомів Гідрогену' записують у такий спосіб:
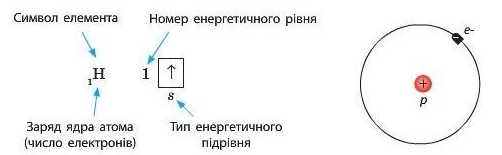
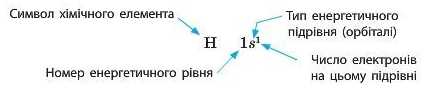
Крім графічного зображення будови електронної оболонки використовують також її запис у вигляді формули — електронної конфігурації.
в якій наводять усі зайняті енергетичні підрівні із зазначенням числа електронів на кожному з них.
Електронна конфігурація Гідрогену має вигляд:

Гелій також розташований у першому періоді, тож в електронній оболонці його атомів так само заповнюється перший енергетичний рівень, що складається з однієї s-орбіталі. Але на цій орбіталі вже міститься два електрони, оскільки порядковий номер Гелію — 2. Згідно з принципом Паулі на одній орбіталі ці електрони мають мати антипаралельні спіни:
У елементів другого періоду починає заповнюватися електронами другий енергетичний рівень. На другому рівні вже два підрівні: s-підрівень (одна орбіталь) і р-підрівень (три орбіталі):
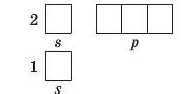
Незалежно від числа енергетичних рівнів, електрони спочатку заповнюють найнижчий рівень, тобто в даному випадку перший, а потім вже другий. Наприклад, розглянемо будову електронної оболонки Літію, що містить три електрони (порядковий номер — 3). Оскільки перший рівень максимально вміщує два електрони, то на другому має міститися тільки один електрон. Як ви вважаєте, яку орбіталь «обере» третій електрон? Згідно з принципом найменшої енергії кожний електрон розташовується в такий спосіб, щоб його енергія була найменшою, отже, серед вільних орбіталей він обирає орбіталь з найнижчою енергією.
Серед усіх орбіталей s-орбіталі мають найменшу енергію, тому єдиний електрон другого енергетичного шару займатиме s-орбіталь, а р-орбіталі в даному випадку залишаться вільними:

Розглянемо будову електронної оболонки Берилію. Його четвертий електрон також має обрати ту саму орбіталь, що й третій електрон Літію. До тих пір, поки не заповниться поточний підрівень, наступний заповнюватися не починає. Так, в атомі Берилію (порядковий номер — 4) повністю заповнений s-підрівень, утворюючи електронну пару, а р-підрівень знову залишається вільним:

Тільки якщо s-орбіталь заповнена, електрони починають розташовуватися на р-орбіталях. Так, в атомі Бору (порядковий номер — δ) на р-орбіталі вже з’являється один електрон:
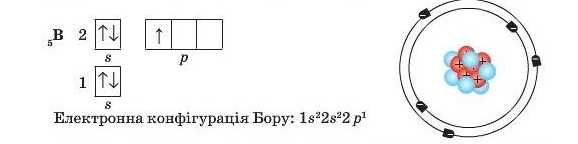
Аналізуючи електронні конфігурації останніх трьох елементів, можна зробити висновок, що в інших елементів другого періоду також будуть заповнюватися електронами орбіталі перших двох енерге-
тичних рівнів, а електронна оболонка кожного наступного елемента буде відрізнятися від електронної оболонки попереднього тільки на один електрон.
Роподіл електронів по орбіталях на енергетичному підрівні
Часто трапляються випадки, коли на підрівнях, що складаються з декількох орбіталей, розміщається декілька електронів. Виникає запитання: які орбіталі вони займають? Наприклад, якщо на /7-підрівні містяться два електрони, то вони можуть зайняти або одну р-орбіталь, або дві різні р-орбіталі:
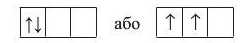
Для такого випадку існує правило, згідно з яким електрон займає вільну орбіталь, а за відсутності вільної — утворює пару з іншим електроном у напівзаповненій орбіталі. Так само, як і люди в тролейбусі спочатку сідають на вільні місця, а якщо вільних місць немає, то підсаджуються до інших пасажирів. Це правило називають правилом Хунда:
У межах одного енергетичного підрівня електрони розподіляються по І орбіталях таким чином, щоб число неспарених електронів було максимальним.

Німецький фізик-теоретик. Народився в місті Карлсруе. У віці 26 років закінчив Геттінгенський університет. Протягом наступних 40 років працював майже у всіх крупних університетах Німеччини. Найважливіші роботи Хунда присвячені квантовій механіці, спектроскопії атомів і молекул, магнетизму, квантовій хімії та історії фізики. У 1927 році сформулював емпіричні правила, що регулюють порядок заповнення атомних орбіталей електронами (правила Хунда). Ввів уявлення про сігма- та пі-зв'язки. Разом із Малікеном і Леннард-Джонсом брав участь у розробці нового методу квантової хімії — методу молекулярних орбіталей.
Тільки якщо на р-підрівні має PoaTanDliBaTHeH більше, ніж три електрони, то «зайвий» електрон утворить електронну пару з іншим електроном, що вже розміщений на цьому підрівні:
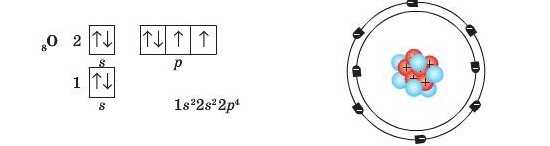
Згідно із цим правилом в електронній оболонці атома Карбону є два неспарені електрони: ^___^
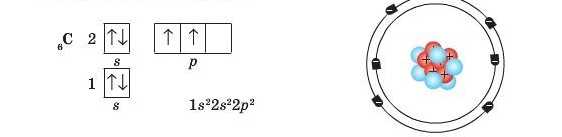
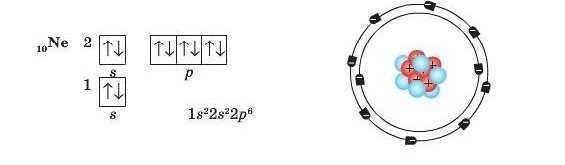
Таким чином в атомах Неону перший та другий енергетичні під-рівні повністю заповнені електронами:
Будова електронних оболонок атомів елементів третього і четвертого періодів
Електронні оболонки атомів інших періодів заповнюються за такими самими правилами. Так, в атомів першого елемента третього
періоду — Натрію — починає заповнюватися третій енергетичний рівень: __
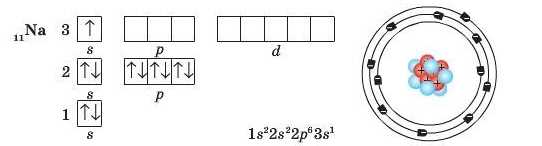
Зверніть увагу, що в атомі Натрію на третьому енергетичному рівні з’являється третій підрівень, що складається з d-орбіталей. Але, як і р-орбіталі, у Натрію орбіталі </-підрівня ще не заповнюються електронами і залишаються вакантними.
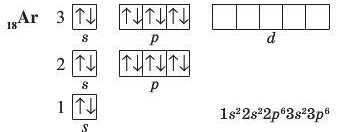
В атомах останнього елемента третього періоду — Аргону — повністю зайняті всі S- і р-орбіталі:
В атомах елементів четвертого періоду починає заповнюватися електронами четвертий енергетичний рівень, не зважаючи на те, що третій рівень ще неповний. Це пов’язано з тим, що енергія 4з-підрівня менша, ніж енергія 3</-підрівня, хоча в даному випадку б/-підрівень розташований на ближчому до ядра електронному рівні. В атомах першого елемента четвертого періоду — Калію — один електрон розташовується на 4з-підрівні:
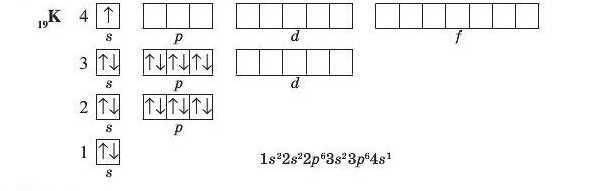
У наступного елемента — Кальцію — 4«-підрівень заповнений повністю.
Отже, ми розглянули основні принципи, що допоможуть зрозуміти будову електронних оболонок атомів перших двадцяти хімічних елементів. Ці принципи є універсальними і виконуються також і для інших елементів. Але для інших елементів необхідно знати ще деякі додаткові правила, які ви вивчатимете при глибшому знайомстві з хімією.
Г“ — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — — - —
Порівняти енергію різних електронних підрівнів можна за допомогою суми двох чисел (п + І). Число п — це номер енергетичного рівня, на якому перебувають орбіталі, а І — це число, що відповідає енергетичному підрівню (типу орбіталі). Так, для s-орбіталей / = 0, для р-орбіталей / = 1, для d-орбіталей І = 2, для f-орбіталей / = 3. Згідно з правилом Клечковського підрівні заповнюються електронами в порядку збільшення суми (п + І). Якщо для двох підрівнів ця сума однакова, то заповнюється той підрівень, що перебуває на ближчому до ядра електронному рівні. Так, для 45-підрівня сума (п + /) дорівнює 4 + 0 = 4, а для Зс/-підрівня сума (л + /) дорівнює 3 + 2 = 5. Отже, енергія 45-підрівня менша, ніж у З^-підрівня, тому він заповнюється раніше.
У такий спосіб можна порівнювати енергії будь-яких енергетичних підрівнів.
Ii — — — · — _ — _ _ _ _ _ _ _ ж м м» —. тшт —. і— — ж — _ «і _ _ — — ж м •· ·· J
Інтелектуальні здібності Паулі значно відрізнялися від його «уміння» працювати руками. Колеги зазвичай жартували з приводу таємничого «ефекту Паулі», коли навіть поява невисокого повненького вченого в лабораторії спричиняла всілякі поломки й аварії.
Висновки
1. На одній орбіталі може перебувати не більше, ніж два електрони, причому їхні спіни мають бути антипаралельними. Орбіталі заповнюються електронами за принципом найменшої енергії: спочатку заповнюється перший енергетичний рівень, потім другий та третій.
2. Якщо на одному енергетичному підрівні містяться декілька електронів, то вони розподіляються таким чином, щоб число неспарених електронів було максимальним.
Контрольні запитання
1. Скільки електронів може максимально перебувати на одній електронній орбіталі?
2. Скільки електронів максимально може перебувати на s-підрівні? р-підрівні? d-підрівні?
3. Який енергетичний рівень заповнюється раніше: перший чи другий? Відповідь поясніть.
4. Чому в атомі Літію електрон, що міститься на другому електронному рівні, перебуває на s-орбіталі, а не на р-орбіталі?
5. Як розподіляються електрони по орбіталях на р-підрівні?
6. Скільки електронів міститься на зовнішньому енергетичному рівні атомів: а) Гелію; б) Літію; в) Берилію; г) Бору; д) Карбону; е) Оксигену?
7. Скільки енергетичних рівнів зайнято електронами в атомах: а) Літію, Натрію, Калію; б) Берилію, Магнію, Кальцію; в) Флуору, Хлору, Брому?
Завдання для засвоєння матеріалу
1. Складіть графічну електронну формулу Нітрогену, Флуору, Магнію, Алюмінію та Силіцію. Визначте число електронних пар та неспарених електронів на зовнішньому енергетичному рівні.
2. За числом орбіталей, що складають енергетичні рівні, визначте, скільки електронів може максимально міститися на другому і третьому енергетичних рівнях.
3. Назвіть два хімічні елементи, в атомах яких повністю заповнені зовнішні енергетичні рівні.
4. Скільки неспарених електронів в електронній оболонці атома Оксигену? Атоми ще якого хімічного елемента другого періоду містять таке саме число неспарених електронів?
5. Зобразіть будову електронних оболонок атомів Нітрогену та Фосфору. Що спільного в будові електронних оболонок цих атомів і чим вони відрізняються?
6. Атоми яких елементів мають наведену електронну конфігурацію зовнішнього електронного рівня: a) Is2; 6) 2s3; в) 2s32p4; г) 3s23p2; д) 4S2I
7. Атом якого елемента другого періоду містить найбільше число: а) електронів; 6) неспарених електронів; в) електронних пар?
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:49, Переглядів: 7141