§ 8. Властивості хімічних елементів та їх сполук залежно від розташування в періодичній системі й будови атома. Сучасне формулювання періодичного закону
— Єдина наука, яка дозволяє учням користуватися шпаргалкою під час відповіді, — це хімія, а шпаргалка —
Періодична система.
— Знаючи, як улаштована Періодична система, можна легко дати загальну характеристику майже будь-якому елементу й описати властивості його сполук. Власне, це й зробив Д. І. Менделєєв, коли передбачив існування ще не відкритих елементів і описав їхні властивості з великою точністю.
Давайте й ми спробуємо розібратися у властивостях елементі] та їх сполук, використовуючи Періодичну систему Д. І. Менделєє ва. У цьому нам допоможуть знання будови атома.
ГРУПИ
Завдання
Напишіть формули вищих оксидів елементів RrA підгрупи.
Ми зараз будемо розглядати тільки елементи головних підгруп Візьмемо, наприклад, RrA підгрупу. Міркуємо так: усі елементі, однієї групи мають на зовнішньому рівні однакове число електро нів. Розподілені вони по орбіталях підрівиів однаково. Однакові електронна будова визначає й подібні властивості. Так, усі ці еле менти проявляють в основному стані валентність II, у промото ваному — вищу валентність IV. Відповідно, формули вищих окси дів для всіх елементів IVA нідгруини однакові й виражен загальною формулою EO2, де E — будь-який елемент IVA нідгру ии. Формула оксиду Карбону в основному стані — CO, де Карбон проявляє валентність II.
Вищим оксидам цих елементів відповідають гідроксиди. Якими будуть гідроксиди Карбону й Силіцію?
Оскільки ці елементи — неметал ІЧНІ, то вони утворюють кислотні оксиди, а гідроксидами, відповідно, будуть кислоти. Металічні елементи утворюють основні оксиди й гідроксиди — основи.
Приклад
Формули гідроксидів для Карбону й Силіцію — кислоти: H2SiO3, H2CO3.
Формули гідроксидів для Кальцію й Натрію — основи: NaOH, Ca(OH)2.
Крім вищих оксидів, у Періодичній системі часто ще вказують леткі сполуки з Гідрогеном. Сполуки з Гідрогеном є в елементів усіх груп, але в елементів 1-ІЙ груп це тверді речовини, а в елементів IV-VH груп — гази.
Якщо під час складання формул вищих оксидів ми враховували, скільки електронів елемент у сполуці може віддати атому іншого елемента, то у водневих сполуках ми враховуємо, скільки електронів атом елемента може прийняти, тобто елемент проявляє нижчу валентність.
Завдання
Напишіть водневі сполуки елементів Карбону, Силіцію, Селену, Хлору, Брому, Фосфору.
Приклад
Яіс QimHCQTH формулу DOflHCDOX
сполуки елемента Сульфуру?
Для завершення зовнішнього рівня атома цього елемента бракує двох електронів, отже, валентність S дорівнює двом, формула H2S.
Крім будови зовнішнього рівня, на властивості атомів впливає й радіус атома.
Завдання
Скільки енергетичних рівнів у атомі Карбону? Силіцію? Германію? Плюмбуму?
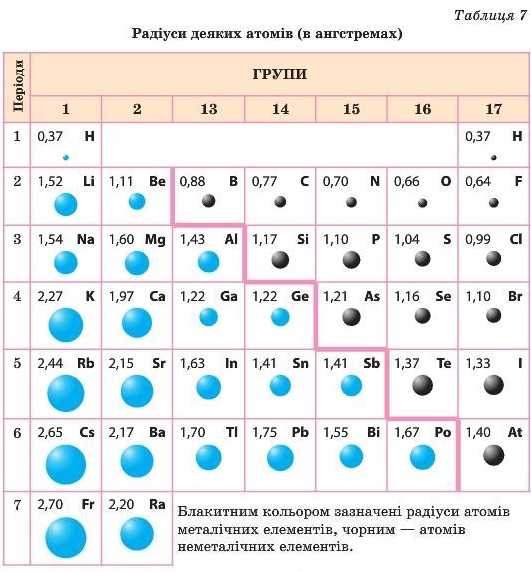
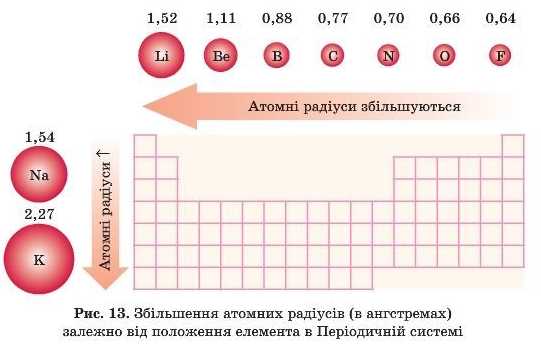
Що таке радіус атома, ми вивчали в § 5. У групах зверху вниз радіус атома збільшується, тому що збільшується число енергетичних рівнів.
Внаслідок збільшення радіуса притягання валентних електронів до ядра слабшає. Варто враховувати й той факт, що більш низькі за енергією електронні рівні, які мають негативний заряд, екранують позитивний заряд ядра й ослаблюють притягання валентних електронів до ядра. Виходить, що в групі зверху вниз електронега-тивність зменшується, тобто атоми будуть легше віддавати електрони. Отже, посилюються металічні властивості. Це очевидно: Карбон — неметалічний елемент, утворює прості речовини — неметали (графіт, алмаз), а Плюмбум — металічний елемент, утворює просту речовину метал — свинець.
Висновок: у групах у зв’язку з однаковою будовою зовнішнього рівня властивості елементів та їх сполук подібні, але не однакові. Зверху вниз у групі збільшуються металічні властивості елементів, а неметалічні слабшають.
ДІЗНАЙТЕСЯ БІЛЬШЕ
Чому Гідроген розташований у І і VII групах? Під час утворення сполук він може віддавати свій єдиний електрон, перетворюючись на йон H1 (як лужні метали), тому він у І групі. Так само Гідроген може приєднувати один електрон, перетворюючись на йон H (як галоген), тому його поміщають і в VII групу.
ПЕРІОДИ
Розглянемо другий період. Це малий період, а малі періоди Д. І. Менделєєв називав типовими, з яскраво вираженою періодичністю зміни властивостей елементів.
Отже, у періоді число енергетичних рівнів не змінюється, воно ж дорівнює номеру періоду. А от число електронів збільшується зліва направо, тому що збільшується номер груп. Також зліва направо зростає електронегативиість.
Як це позначається на властивостях елементів та їх сполук? Розглянемо властивості елементів другого періоду.
Починає другий період металічний елемент — Літій. З атомів Літію складається проста речовина — лужний метал літій. Це активний метал, він утворює основний оксид Li2O і розчинний гідроксид — основу LiOH. Наступний елемент — Бор — неметалічний елемент, він утворює просту речовину-неметал — бор, кислотний оксид B2O3 і відповідний йому гідроксид — слабку боратну кислоту H3BO3. Між Літієм і Бором розташований Берилій. Цей елемент
проявляє властивості, подібні й до металів, і до неметалів. Він утворює амфотерні оксиди й гідроксиди. Докладніше ми будемо вивчати їх далі.
Виявляється, різкої межі між металічними й неметалічними елементами в Періодичній системі немає. Перехід здійснюється через елементи, які утворюють амфотерні сполуки.
За Бором ідуть неметалічні елементи — Карбон, Нітроген. Відповідні прості речовини — вуглець, азот. Ці елементи утворюють кислотні оксиди й кислоти. Потім розташовані Оксиген і Флуор. Проста речовина, яка складається з атомів Оксигену, — кисень — оксидів і кислот не утворює. Сполуку Флуору й Оксигену називають не оксид Флуору, а оксиген флуорид — OF2, оскільки тут більш електронегативним елементом є Флуор. Закінчується період інертним газом.
Якщо ми розглянемо 3-й період — картина подібна. Починається він з активного металічного елемента — Натрію, потім іде металічний елемент — Магній; елемент, який утворює амфотерні сполуки, — Алюміній. За ними розташовані неметалічні елементи — Силіцій, Фосфор, Сульфур, Хлор, і закінчується період знову інертним газом — Аргоном.
За таблицею 6 простежте, як змінюються загальні формули вищих оксидів і характер гідроксидів елементів у 3-му періоді.
Завдання
Запишіть загальні формули вищих оксидів і гідроксидів елементів третього періоду, позначивши символ елемента літерою Е.
Розглянемо ще два питання.
1. Чому змінюються властивості елементів та їх сполук у періодах?
Міркуємо так: число енергетичних рівнів не змінюється, число електронів на зовнішньому рівні збільшується. Що відбувається з радіусом атома? Він зменшується! Чому? Згадаємо фізику, закон Кулона. Сила притягання між зарядами різних знаків збільшується зі збільшенням величини цих зарядів.
Де сили притягання між ядром і електроном більші: у Літію +3 і -1 чи у Флуору +9 і -1?
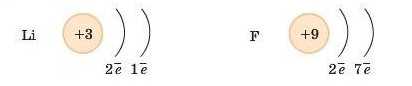
Чим більше притягання електронів до ядра, тим менше його атомний радіус. Чим сильніше притягання електронів до ядра, тим більша його електронегативність, тим більше виражені неметал Ічні властивості елемента (табл. 7).
Таблиця 6
Зміна властивостей CnonjrK елементів III періоду
|
Елементи |
Формула вищого оксиду |
Властивості оксиду |
Формула гідрату оксиду |
Властивості гідрату оксиду |
|
Na |
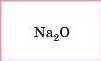 |
Основні |
 |
Розчинна сильна основа |
|
Mg |
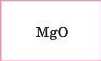 |
Основні |
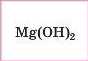 |
Нерозчинна основа |
|
Λ1 |
 |
Амфотерні |
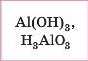 |
Амфотерна сподука |
|
Si |
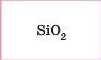 |
Кислотні |
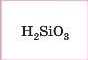 |
Нерозчинна слабка кислота |
|
P |
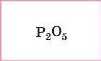 |
Кислотні |
 |
Розчинна кислота середньої сили |
|
S |
 |
Кислотні |
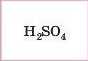 |
Розчинна сильна кислота |
|
Cl |
 |
Кислотні |
 |
Розчинна дуже сильна кислота |
Оскільки інертні (або благородні) гази мають завершений зовнішній рівень (усі електрони спарені), то їхня електронегативність дорівшоє нулю. Вони вкрай важко вступають у хімічні реакції, а для Гелію й Неону досі не отримано жодної сполуки.
Очевидно, у Флуору. Флуор — найбільш активний неметал із найвищою електроиегативністю.
Завдання
Напишіть електронні формули для таких елементів:
а) Літій, Натрій;
б) Карбон, Силіцій;
в) Флуор, Хлор;
г) Неон, Аргон. Порівняйте їх.
2. Чому зміни властивостей елементів періодично повторюються?
Зіставимо зміну властивостей хімічних елементів, які ми тільки-но розглянули, зі зміною будови зовнішнього електронного рівня їхніх атомів.
Ми бачимо, що будова зовнішнього рівня атомів у періодах періодично повторюється. При цьому періодично змінюються такі параметри, як валентність, радіус атома, електро-негативність і, нарешті, металічні й неметалічні властивості елементів (табл. 7).
Таким чином, причиною періодичної зміни (періодичної повторюваності) властивостей хімічних елементів є періодична повторюваність будови зовнішніх електронних оболонок атомів.
У цьому полягає фізична сутність періодичного закону.
Отже, періодичність у зміні властивостей елементів обумовлена числом електронів у атомі, електронною структурою атома, яка періодично змінюється в міру збільшення загального числа електронів.
Давайте згадаємо, що число електронів у атомі дорівнює позитивному заряду атомного ядра й, відповідно, порядковому (атомному) номеру елемента в Періодичній системі елементів Д. І. Менделєєва.
Звідси сучасне формулювання періодичного закону:
Властивості елементів, а також властивості утворених ними простих і складних сполук перебувають у періодичній залежності від величини зарядів їхніх атомних ядер.
ДІЗНАЙТЕСЯ БІЛЬШЕ
Зверніть увагу, що атомні маси елементів, як правило, збільшуються в тій самій послідовності, що й заряди атомних ядер (згадаємо, що протони мають заряд +Ii масу 1). Тому сучасна форма таблиці Періодичної системи елементів збігається із запропонованою Д. І. Менделєєвим формою, хоча він брав за основу систематизації масу атомів. Аргон, Кобальт, Телур розташовані в таблиці не за порядком збільшення атомної маси, а на основі їхніх хімічних властивостей.
Цю невідповідність супротивники Д. І. Менделєєва вважали недоліком його системи, але, як пізніше було доведено, закономірність порушується у зв’язку з ізотопним складом елементів, що також передбачав Д. І. Менделєєв.
ХАРАКТЕРИСТИКА ХІМІЧНИХ ЕЛЕМЕНТІВ МАЛИХ ПЕРІОДІВ ЗА ЇХНІМ МІСЦЕМ У ПЕРІОДИЧНІЙ СИСТЕМІ ТА БУДОВОЮ АТОМА
Знаючи періодичну систему, можна дати характеристику будь-якому елементу. Зазвичай використовують такий план:
1. Положення елемента в системі: період, група, підгрупа.
2. Кількість протонів, нейтронів, електронів у його атомі.
3. Будова атома (електронно-графічна й електронна формули).
4. Кількість валентних електронів в основному й промотованому станах.
δ. Електронна родина: s-, р-, d-eлемент.
6. Металічний, неметалічний елемент.
7. Формула вищого оксиду й гідроксиду, що йому відповідає, їхній характер (основний, амфотерний, кислотний).
8. Формула леткої водневої сполуки.
9. Порівняння металічних (чи неметалічних) властивостей і радіуса атома елемента із сусідами по групі й періоду.
ЗНАЧЕННЯ ПЕРІОДИЧНОГО ЗАКОНУ
Д. І. Менделєєвим було відкрито взаємний зв’язок між усіма елементами, їхніми фізичними й хімічними властивостями. Після відкриття Періодичного закону стало зрозуміло, що атоми всіх елементів мають бути побудовані за єдиним принципом, а їхня будова має відображати періодичність властивостей елементів. Таким чином, періодичний закон став важливою ланкою в еволюції атомно-молекулярного вчення, вилинувши на розробку теорії будови атома. Він також сприяв формулюванню сучасного поняття «хімічний елемент» і уточненню уявлень про прості й складні речовини.
Використовуючи Періодичний закон, Д. І. Менделєєв став першим дослідником, який зумів розв’язати проблеми прогнозування в хімії. Це виявилося вже через кілька років після створення Періодичної системи елементів, коли було відкрито передбачені Менделєєвим нові хімічні елементи. Періодичний закон допоміг також уточнити багато особливостей хімічної поведінки вже відкритих елементів. Успіхи атомної фізики, включаючи ядерну енергетику й синтез штучних елементів, стали можливими лише завдяки Періодичному закону. У свою чергу, вони розширили й поглибили сутність закону Менделєєва, розширили межі Періодичної системи елементів.
Періодичний закон є універсальним законом. Він належить до числа таких загальних наукових закономірностей, які реально існують у нрироді й тому в процесі еволюції наших знань ніколи
не втратять свого значення. Із часом роль Періодичного закону не зменшується. Він став найважливішою основою неорганічної хімії. Його використовують, наприклад, під час синтезу речовин із заздалегідь заданими властивостями, створення нових матеріалів, підбирання ефективних каталізаторів.
Неоціненним є значення Періодичного закону у викладанні загальної та неорганічної хімії. Його відкриття було пов’язане зі створенням підручника з хімії, коли Менделєєв намагався гранично чітко викласти відомості про відомі на той момент 63 хімічних елементи. Зараз число елементів збільшилося майже вдвічі, і Періодичний закон дозволяє виявляти подібність і закономірності властивостей різних хімічних елементів із використанням їхнього розташування в Періодичній системі.
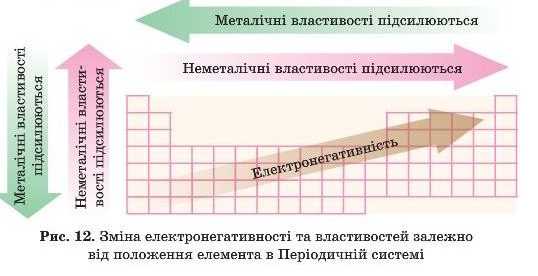
Підіб’ємо підсумки в табл. 8 і рис. 12 і 13.
Таблиця 8
Зміна будови атома й властивостей елементів у групах і періодах зі збільшенням порядкового номера елемента
|
Число енерге тичних рівнів |
Число електронів на зовнішньому рівні |
Радіус атома |
Електро- негатив- ність |
Зміна металічних і неметалічннх властивостей |
|
|
Період |
Не змінюється |
Збільшу ється |
Змен шується |
Збільшу ється |
Підсилюються неметалічні властивості |
|
Групи |
Збільшу ється |
Не змінюється |
Збіль шується |
Зменшу ється |
Металічні властивості підсилюються |
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Чи змінюється в групах зверху вниз число електронів на зовнішньому енергетичному рівні атомів елементів? число електронних рівнів? Поясніть чому.
2. Чи змінюється в періодах зліва направо число електронів на зовнішньому енергетичному рівні атомів елементів? число електронних рівнів? Поясніть чому.
3. Як змінюється електронегативність у атомів елементів зі збільшенням порядкового номера в групах? у періодах?
4. Поясніть посилення неметалічних властивостей елементів зі збільшенням заряду ядра їхніх атомів:
а) у періодах;
б) у групах.
5. Як теорія будови атома пояснює періодичність у зміні властивостей хімічних елементів по групах та періодах? Відповідь ілюструйте прикладами.
6. У чому фізичний зміст періодичного закону?
7. Наведіть сучасне формулювання періодичного закону.
8. Як змінюються радіуси атомів елементів у межах:
а) одного періоду;
б) групи?
Чому? Зіставте зміну радіусів зі зміною властивостей елементів II періоду та IV групи головної підгрупи.
Завдання
Визначте валентність атома Хлору в основному та промотованому станах. Для цього спочатку запишіть електрон н о-графічну формулу атома. Відповідь 3 дивіться н кінці параграфа.
Завдання
Визначте вищу валентність для таких елементів:
S, Se, Br, Al.
1. Розташуйте за порядком збільшення атомного радіуса такі елементи: Силіцій, Магній, Аргон, Фосфор.
2. Розташуйте за порядком зменшення електронегативності такі елементи: Плюмбум, Карбон, Германій, Станум.
3. Розташуйте за порядком посилення кислотних властивостей сполук такі елементи: Хлор, Сульфур, Алюміній, Фосфор.
4. Розташуйте за порядком посилення основних властивостей сполук такі елементи: Станум, Германій, Силіцій, Плюмбум.
5. Визначте елемент і обчисліть відносну молекулярну масу вищого оксиду й леткої водневої сполуки, до складу яких входить елемент III періоду VI групи головної підгрупи.
6. '^Назвіть елемент, що має формулу леткої водневої сполуки RHa і утворює вищий оксид із відносною молекулярною масою 142. Укажіть його положення в Періодичній системі: період, групу, підгрупу. Напишіть рівняння реакцій цього оксиду з водою. У який колір забарвиться універсальний індикатор в отриманому розчині?
7. Установіть відповідність між вищими оксидами хімічних елементів і їхньою відносною молекулярною масою.
Вищий оксид елемента Відносна молекулярна маса
1. Калію а) 102 г) 94
2. Алюмінію б) 44 д) 90
3. Карбону в) 40
4. Магнію
8. Установіть відповідність між леткими водневими сполуками
хімічних елементів і їхньою відносною молекулярною масою. JIетка воднева сполука елемента Відносна молекулярна маса
1. Оксигену а) 34
2. Фосфору б) 16
3. Карбону в) 18
4. Флуору г) 20
Д) 19
9. Установіть послідовність посилення металічних властивостей атомів елементів:
а) Калій; в) Натрій;
б) Магній; г) Алюміній.
10. Установіть послідовність посилення неметалічних властивостей атомів елементів:
а) S; в) О;
б) Se; г) F.
1. Напишіть графічну й електронну формули атомів елементів № 5, 12, 17.
2. Елемент розташований у III періоді, І групі головної підгрупи. Визначте цей елемент і підрахуйте кількість протонів і електронів у атомі цього елемента. Напишіть графічну й електронну формули атома цього елемента.
3. У невідомого елемента на третьому, останньому, шарі електронів удвічі більше, ніж на останньому шарі в атомі Магнію. Визначте невідомий елемент А. Напишіть графічну й електронну формули атома елемента А.
4. Відносна молекулярна маса вищого оксиду елемента IV групи дорівнює 44. Про який елемент ідеться? Металічні чи немета-лічні властивості проявляє цей елемент? У яких двох елементів — сусідів по періоду й групі — ці властивості будуть менш яскраво виражені? Напишіть графічну й електронну формули атома цього елемента.
5. Відносна молекулярна маса леткої водневої сполуки елемента VI групи дорівнює 34. Про який елемент ідеться? Яка формула й характер (основний чи кислотний) його вищого оксиду? Напишіть графічну й електронну формули атома цього елемента.
6. Кількість електронів на зовнішньому енергетичному рівні в атомі елемента А втричі більша, ніж у атомі Кальцію на зовнішньому енергетичному рівні. Електрони в атомі елемента А розташовані на трьох енергетичних рівнях. Визначте елемент А, запишіть формулу вищого оксиду цього елемента й гідроксиду, що йому відповідає, вкажіть характер цих сполук.
7. Назвіть елемент, що має формулу леткої водневої сполуки RH2 і утворює вищий оксид з відносною молекулярною масою 127. Дайте характеристику цього елемента за планом:
1) Положення елемента в системі: період, група, підгрупа.
2) Кількість протонів, нейтронів, електронів.
3) Будова атома.
4) Кількість валентних електронів.
5) Металічний, неметалічний елемент.
6) S-, р-, d-елемент.
7) Формула вищого оксиду й гідроксиду, що йому відповідає, їхній характер (основний, амфотерний, кислотний).
8) Формула леткої водневої сполуки.
9) Порівняння металічних (чи неметалічних) властивостей і радіуса атома елемента із сусідами по групі й періоду.
ХІМІЧНИЙ ЗВ'ЯЗОК І БУДОВА РЕЧОВИНИ
2
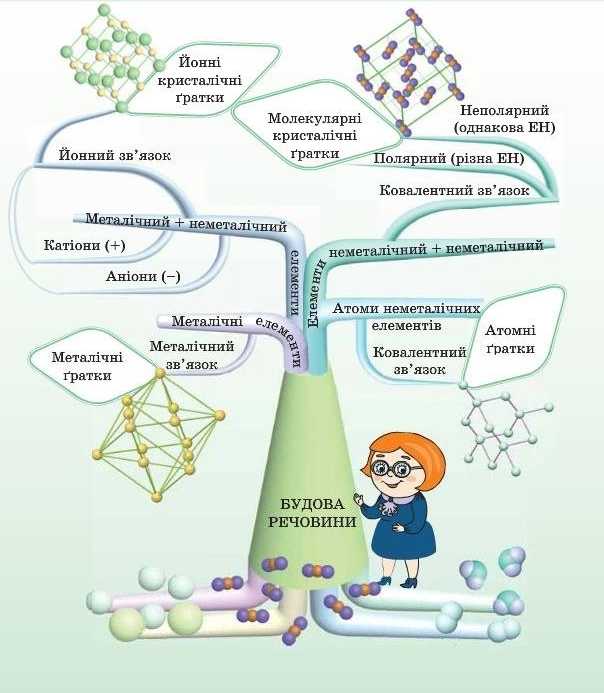
Ви знаєте, що хімія вивчає властивості речовин. Відповідно до властивостей речовин ми ї.г і застосовуємо: милом миємо руки, а цукор кладемо в чай. І от що важливо: властивості речовин залежать від їхньої будови! Виходить, якщо ми знаємо будову речовини, то можемо припустити, де їі можна використовувати. А якщо нам знадобиться речовина із зовсім незвичайними властивостями, чи можна заздалегідь визначити, якою повинна бути будова? Зараз ми про це й поговоримо.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:00, Переглядів: 16277