Властивості та використання основ
Матеріал параграфа допоможе вам:
• з'ясувати фізичні властивості основ;
• засвоїти хімічні властивості основ;
• прогнозувати можливість реакції лугу із сіллю;
• дізнатися про сфери використання лугів.
Фізичні властивості основ. Вам відомо, що кожна основа складається із позитивно заряджених йонів металічного елемента і гідроксид-іонів ОН". Основи, як і йонні оксиди, за звичайних умов є твердими речовинами. Вони повинні мати досить високі температури плавлення. Однак при помірному нагріванні майже всі основи розкладаються на відповідний оксид і воду. Розплавити можна лише гідроксиди Натрію і Калію (температури плавлення цих сполук становлять, відповідно, 322 і 405 °С).
Більшість основ не розчиняється у воді (мал. 53). Малорозчинними є гідроксиди Mg(OH)2, Ca(OH)2 і Sr(OH)2, а добре розчинними — основи, утворені лужними елементами (Li, Na, К, Rb, Cs), і сполука Ba(OH)2. Ви знаєте, що водорозчинні основи називають лугами.
Луги та їх розчини милкі на дотик, «роз’їдають» багато матеріалів, спричиняють серйозні


опіки шкіри, слизових оболонок, сильно вражають очі (мал. 54). Тому натрій гідроксид має тривіальну назву «їдкий натр». Працюючи з лугами та їх розчинами, будьте особливо обережними. Якщо розчин лугу потрапив на руку, потрібно негайно змити його великою кількістю проточної води і звернутися за допомогою до вчителя або лаборанта. Ви отримаєте розбавлений розчин певної речовини (наприклад, оцтової кислоти), яким обробляють шкіру для знеишодження залишків лугу. Після цього руку слід добре промити водою.
Мал. 55. Забарвлення індикаторів У воді (а) та розчині лугу (б)
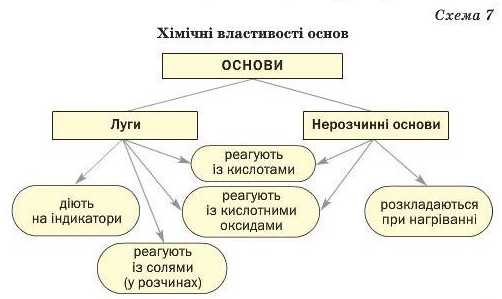
Хімічні властивості основ. Можливість перебігу багатьох реакцій за участю основ залежить від розчинності цих сполук у воді. Луги в хімічних перетвореннях значно активніші за нерозчинні основи, які, наприклад, із солями та деякими кислотами не реагують.
Дія на індикатори. Розчини лугів здатні змінювати забарвлення індикаторів (мал. 55). Відповідні досліди ви виконували в 7 класі.
Нерозчинні основи на індикатори не діють.

ЛАБОРАТОРНИЙ ДОСЛІД № 2
Дія водних розчинів лугів на індикатори
У пробірку з гранулою натрій гідроксиду налийте води до половини об’єму пробірки і, перемішуючи скляною паличкою, розчиніть сполуку. Доторкніться паличкою, змоченою виготовленим розчином, до смужки універсального індикаторного папірця. Що спостерігаєте?
Розподіліть розчин лугу у три пробірки. В одну пробірку добавте 1—2 краплі розчину лакмусу, в другу — стільки ж розчину фенолфталеїну, а в третю — розчину метилоранжу. Як змінюється забарвлення кожного індикатора?
Пробірку з розчином лугу і фенолфталеїном збережіть для наступного досліду.
Реакції з кислотними оксидами. Розчинні й нерозчинні основи взаємодіють зі сполуками протилежного характеру, тобто такими, які мають кислотні властивості. Серед цих сполук — кислотні оксиди. Відповідні реакції було розглянуто в § 27. Наводимо додаткові приклади:
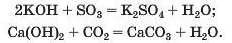
Реакції з кислотами. Під час взаємодії основи з кислотою сполуки обмінюються частинками, з яких вони складаються:
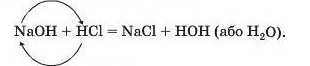
Це — реакція обміну.
З’ясувати, чи залишився луг після добавляння певної порції кислоти, можна, добавивши до рідини 1—2 краплі розчину фенолфталеїну. Якщо малиновий колір не з’явився, то луг повністю прореагував із кислотою.
Приклад реакції нерозчинної основи з кислотою:
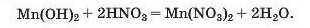
Реакцію між основою і кислотою називають реакцією нейтралізації.
ЛАБОРАТОРНИЙ ДОСЛІД № З
Взаємодія лугів з кислотами в розчині
У пробірку з розчином натрій гідроксиду і фенолфталеїном, що залишилася після лабораторного досліду 2, додавайте по краплях за допомогою піпетки розбавлений розчин сульфатної кислоти, доки не зникне забарвлення. Вміст пробірки періодично перемішуйте скляною паличкою або струшуванням.
Чому розчин знебарвився?
Напишіть відповідне хімічне рівняння.
Реакції нейтралізації часто використовують для видалення лугів або кислот зі стічних вод промислових підприємств. Продукти таких реакцій — солі — безпечні для навколишнього середовища. Дуже ефективною й економічно вигідною є взаємна нейтралізація лужних і кислотних стоків різних виробництв.
Реакції лугів із солями. Взаємодія лугу із сіллю є реакцією обміну, яка відбувається в розчині. Вихідна сіль має бути розчинною у воді, а нова основа чи сіль — нерозчинною.
З’ясуємо можливість реакції між натрій гідроксидом і манган(ІІ) нітратом. Для цього скористаємось таблицею розчинності (наводимо її фрагмент):
|
Аніони |
Катіони |
|||||||
 |
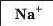 |
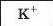 |
 |
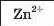 |
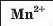 |
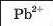 |
 |
|
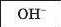 |
 |
 |
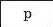 |
 |
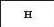 |
 |
 |
 |
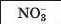 |
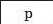 |
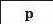 |
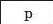 |
 |
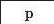 |
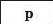 |
 |
 |
Луг NaOH і сіль Mn(NO3)2 розчиняються у воді. Вони обміняються своїми йонами в тому разі, якщо утвориться нерозчинна сполука. Нею
є основа Mn(OH)2, а нова сіль NaNO3 перебуватиме в розчині. Отже, реакція між натрій гідроксидом і манган(ІІ) нітратом можлива:
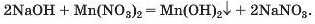
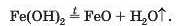
► Чи може взаємодіяти барій гідроксид із калій карбонатом у розчині? У разі позитивної відповіді напишіть відповідне хімічне рівняння.
Термічний розклад. Майже всі основи (крім гідроксидів Натрію і Калію) при нагріванні розкладаються на відповідний оксид і воду (водяну пару):
Амонійна основа (водний розчин амоніаку) подібно до лугів змінює забарвлення індикаторів, взаємодіє з кислотними оксидами, кислотами, солями:
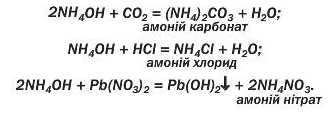
Викладений матеріал підсумовує схема 7.
Використання основ. Широкого застосування серед основ набули лише луги, передусім гідроксиди Кальцію і Натрію. Вам відомо, що речовиною з назвою «гашене вапно» є кальцій гідроксид Ca(OH)2- Гашене вапно використовують як в’яжучий матеріал у будівництві. Його змішують із піском і водою. Виготовлену суміш наносять на цеглу, нею штукатурять стіни. Унаслідок реакцій гашеного вапна з вуглекислим газом і силіцій(ІУ) оксидом суміш твердне.
► Складіть рівняння цих реакцій.
Кальцій гідроксид також застосовують у цукровій промисловості, сільському господарстві, при виготовленні кальцій карбонату для зубних паст, добуванні інших речовин. Натрій гідроксид використовують при виробництві мила (здійснюють реакції лугу із жирами), ліків, у шкіряній промисловості, для очищення нафти тощо.
Основи — тверді речовини йонної будови. Більшість основ не розчиняється у воді. Водорозчинні основи називають лутами. Луги змінюють забарвлення індикаторів.
Основи взаємодіють із кислотними оксидами і кислотами з утворенням солей та води. Луги реагують у розчинах із солями; продукти кожної реакції — інші основа і сіль. Нерозчинні основи розкладаються при нагріванні на відповідні оксиди і воду.
Реакцію між основою і кислотою називають реакцією нейтралізації.
На практиці використовують переважно гідроксиди Кальцію і Натрію.
223. Охарактеризуйте фізичні властивості основ. Що таке луг?
224. Які речовини називають індикаторами? Як змінює забарвлення кожний індикатор за наявності лугу в розчині?
225. Наведіть приклади реакцій обміну, нейтралізації, розкладу за участю основ.
226. Допишіть схеми реакцій і складіть хімічні рівняння:

227. Напишіть рівняння реакцій (якщо вони можливі) між основами (у лівому стовпчику) і солями (у правому стовпчику):
калій гідроксид кальцій карбонат
манган(ІІ) гідроксид ферум(ІІ) нітрат
барій гідроксид натрій сульфат
228. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі послідовні перетворення:
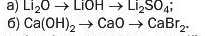
229. Яка кількість речовини магній гідроксиду вступає в реакцію із 12,6 г нітратної кислоти?
230. Обчисліть масу ферум(ІІ) гідроксиду, що утворюється при взаємодії 0,05 моль натрій гідроксиду з достатньою кількістю ферум(ІІ) сульфату.
231. Який об’єм сірчистого газу (н. у.) необхідний для повного осадження йонів Барію (у складі нерозчинної солі) із розчину, що містить 34,2 г барій гідроксиду?
232. Яка маса осаду утвориться в результаті взаємодії 22,4 г калій гідроксиду з достатньою кількістю манган(ІІ) хлориду?
233. На нейтралізацію 25,1 г суміші гідроксидів Натрію та Барію витратилося 25,2 г нітратної кислоти. Визначте масову частку натрій гідроксиду у вихідній суміші.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:55, Переглядів: 8066