§ 32. Фізичні властивості основ. Хімічні властивості розчинних і нерозчинних основ. Реакція нейтралізації
Опанувавши матеріал параграфа, ви зможете:
• називати фізичні властивості: а) лугів; б) нерозчинних у воді основ;
• розпізнавати розчини лугів і відрізняти їх від розчинів кислот;
• характеризувати хімічні властивості лугів і нерозчинних основ;
• складати рівняння реакцій, що підтверджують властивості лугів і нерозчинних основ.
Пригадайте та сформулюйте визначення поняття «основа».
Фізичні властивості основ. За нормальних умов розчинні у воді основи — луги — тверді кристалічні, білого кольору речовини. Переважно всі вони розчиняються у воді в будь-яких відношеннях, утворюючи прозорі розчини, мильні на д<угик. Кальцій гідроксид малорозчинний. Під час розчинення лугів у воді виділяється тепло. Основи, утворені лужними та лужноземельними металами, гігроскопічні, роз'їдають органічні речовини (целюлозу, білок). Звідси пішли назви натрій і калій гідроксидів, відповідно: їдкий напір і їдке калі. У зв’язку з цим під час роботи з лугами необхідно дотримуватися поданих нижче правил техніки безпеки (с. 173 174).
Нерозчинні основи — тверді речовини з різним забарвленням: ферум(ІІ) гідроксид Fe(OH)1, зеленувато-білий; ферум(ІІІ) гідроксид Fe(OH)., — бурий; цинк гідроксид Zn(OH)2 — білий, купрум(H) гідроксид синій.
Укажіть ознаки, за якими класифікують основи, і назвіть відомі вам групи цих речовин.
Заходи безпеки під час роботи з лугами. Відомо, що з розчинами лугів необхідно поводитися дуже обережно, оскільки вони роз’їдають шкіру, слизову оболонку очей, напір, тканину. Тверді луги ще інтенсивніше діють на органічні речовини. Для них властиве явище гігроскопічності (вбирання водяної пари з повітря), тому їх не можна брати руками.
Отже, під час роботи з твердими лугами та їх розчинами треба дотримуватися правил безпеки, зокрема:
тверді луги (гранули) тримати в закритій посудині, щоб ізолювати від вологи й вуглекислого газу, який є в повітрі;
— не брати речовини руками, не розбризгуваги;
працюючи з розчинами, треба поводитися дуже акуратно, стежити, щоб луг не потрапляв на одяг, зошити й книжки, не розливати його па робочому місці;
одягнути халат або фартух, гумові рукавиці й захисні окуляри, якщо досліди виконуються з концентрованими лугами.
Якщо луг потрапив на шкіру, треба негайно змити це місце великою кількістю проточної води й нейтралізувати розчином борної або лимонної кислоти. Якщо опіки сильні, потрібно обов’язково звернутися до лікаря.
Якщо луг потрапив у очі, треба їх ретельно промити розчином борної кислоти й також звернутися до лікаря.
Хімічні властивості розчинних у воді основ. Вам відомо, що існують розчинні у воді основи (луги) та нерозчинні. Розглянемо хімічні властивості цих двох груп основ.
Пригадайте склад основ і поясніть, що впливає на спільні властивості цих сполук.
До складу основ входять катіони металічних елементів і гід-роксид-аніони (гідроксильні групи). Оскільки катіони металів у складі основ різні, то спільні властивості цього складу речовин зумовлені наявністю гідроксид-аиіонів.
Охарактеризуємо хімічні властивості лугів.
1. Дія лугів на індикатори.
Як і кислоти, луги проявляють здатність змінювати забарвлення індикаторів. Дослідимо зміну забарвлення індикаторів у лужному середовищі, виконавши лабораторний дослід.
Лабораторний дослід 4
ДІЯ ВОДНИХ РОЗЧИНІВ ЛУГІВ НА ІНДИКАТОРИ
Завдання 1. Дослідіть дію розчинів лугів па індикатори: лакмус, метиловий оранжевий, фенолфталеїн, універсальний індикаторний папір.
Обладнання й реактиви: пробірки; розчини натрій і калій гідроксидів; розчини індикаторів, універсальний індикаторний папір.
Увага! Повторіть правила безпеки під час роботи з лугами та кислотами й суворо дотримуйтесь їх.
Хід роботи
Дослід 1. Налийте розчин натрій гідроксиду об’ємом 0,5 мл у три пробірки та хімічний стакан. Додайте по кілька крапель: у першу — розчин лакмусу; у другу — метилового оранжевого; у т|к:-тю — фенолфталеїну. До розчину лугу в хімічному стакані опустіть універсальний індикаторний напір (рис. 77).
Дослід 2. Виконайте такі самі дослідження з розчином кал і й гідроксиду.
Спостерігайте зміну забарвлення індикаторів і впишіть у таблицю свої спостереження. Зробіть відповідний висновок.
|
Індикатори |
Зміна забарвлення в лугах |
|
|
натрій гідроксид |
калій гідроксид |
|
|
Лакмус |
||
|
Метиловий оранжевий |
||
|
Фенолфталеїн |
||
|
У н і нерсал ьн и й індикатерний напір |
||
 |
||
Як ви переконалися з лаоораторного досліду, у розчинах лугів лакмус змінює своє забарвлення на синій колір, метиловий оранжевий на жовтий, а фенолфталеїн на малиновий. Універсальний індикаторний папір у лужному середовищі стає синім.

2. Взаємодія лугів з кислотними оксидами.
Під час вивчення кислотних оксидів ви вже ознайомилися з цією властивістю розчинних у воді основ (due. § 27). Наведемо інші приклади взаємодії лугів а кислотними оксидами:
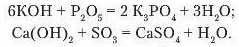
Проаналізувавши рівняння реакцій, ви впевнилися, що під час реакцій лугів з кислотними оксидами утворюється новий клас речовин солі й вода.
Поясніть, до якого типу належать вище подані хімічні реакції. Сформулюйте їх визначення.
3. Взаємодія лугів із солями.
Розчинні у воді основи взаємодіють з розчинами солей. Доведемо це експериментально, виконавши наступний лабораторний дослід.
Лабораторний дослід 5 ВЗАЄМОДІЯ ЛУГІВ ІЗ СОЛЯМИ
Завдання 1. Дослідіть взаємодію між розчинами кун-рум(ТЇ) хлориду та натрій гідроксиду.
Обладнання й реактиви: пробірки; розчини нагрій гідроксиду та куирум(ІІ) хлориду.
Увага! Повторіть правила безпеки під час роботи з лугами та кислотами й суворо дотримуйтесь їх.
Хід роботи
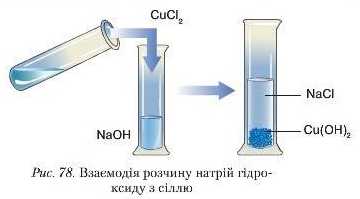
Дослід 1. До пробірки з розчином натрій гідроксиду об’ємом 1 1.5 мл долийте такий самий об’єм розчину купрум(ІІ) хлориду (рис. 78).
У результаті реакції спостерігається випадання синього осаду купрум(ЇІ) гідроксиду:
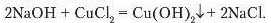
Варто зазначити, що реакції між розчинами лугів і солей відбуваються за тих самих умов, що й взаємодія кислот із солями.
Пригадайте умови перебігу реакцій.
4. Взаємодія лугів із кислотами.
Ця властивість основ вам уже відома. Для кращого засвоєння матеріалу проведемо наступний лабораторний дослід. Щоб спостерігати перебіг хімічних реакцій, скористаємося індикаторами.
Лабораторний дослід 6
ВЗАЄМОДІЯ ЛУГІВ З КИСЛОТАМИ В РОЗЧИНІ
Завдання і. Дослідіть взаємодію лугів із кислотами. Зробіть відповідні висновки.
Обладнання й реактиви: штатив з пробірками; препарувальне скельце; нагрівам; піпетка; тримач; розчини натрій, калій та кальцій гідроксидів, фенолфталеїну; хлоридпа кислота.
Увага! Повторіть правила безпеки під час роботи з лугами та кислотами і суворо дотримуйтесь їх.
Хід роботи
Дослід 1. Утри пробірки налийте но черзі (обережно!) розчини натрій, калій та кальцій (вапняна вода) гідроксидів об’ємом но 1 1,5 мл. До кожної з них крапніть но кілька крапель фенолфталеїну. Потім прилийте приблизно такі ж об’єми кислот: у першу пробірку хлоридної кислоти; у другу — сульфатної, а в третю нітратної. Які зміни спостерігаєте? Впишіть спостереження в таблицю. Зробіть висновки про спостережувані явища.
|
Розчини лугів |
Зміна забарвлення після доливання фенолфталеїну |
Назви кисло-що реагують із л |
г, гами |
Зміна забарвлення після доливання кислоти |
|
|
хлоридна |
суль фатна |
нітратна |
|||
|
NaOH |
|||||
|
KOiI |
|||||
|
Ca(OH)2 |
|||||
 |
|||||
Дослід 2. Крапніть на препарувальне скельце кілька крапель розчину речовини, що утворилася після реакції, й обережно випаруйте. ІДо спостерігаєте? Запишіть висновок.
Висновок:
Напишіть самостійно рівняння реакцій між лугами та кислотами, які ви використовували в досліді.
Як ви переконалися, продуктами реакцій є сіль відповідної кислоти і воііа.
Пригадайте, властивості яких іще речовин характеризують такі реакції.
Реакції між основою і кислотою з утворенням солі та води називаються реакціями нейтралізації.
Чому, на ваш погляд, саме так називають цю реакцію?
Дійсно, у процесі перебігу реакції кислота нейтралізувала луг. Реакції нейтралізації мають практичне застосування. У побуті, коли на шкіру потрапляє кислота, уражене місце промивають проточною водою і нейтралізують слабким розчином лугу.
Хімічні властивості нерозчинних основ.
1. Взаємодія нерозчинних основ із кислотами.
Постає питання: чи взаємодіють нерозчинні у воді основи з кислотами, і якщо так, то що є продуктами реакцій?
Звернемося до досліду.
Дослід 1. У нашому випадку можемо використати добуту нерозчинну основу куирум(ІІ) гідроксид або добути заново. Для цього до розчину кунруму(ІІ) сульфату доллємо розчин иатрі й гідроксиду.
Напишіть самостійно рівняння реакції утворення купрум(ІІ) гідроксиду.
До осаду добутої нерозчинної основи доллємо хлоридиу кислоту (рис. 79). Осад розчиняється й утворюється блакитний розчин солі к\чірум(ІІ) хлориду:
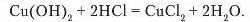
Продуктами реакції є, знову ж таки, сіль і вода.
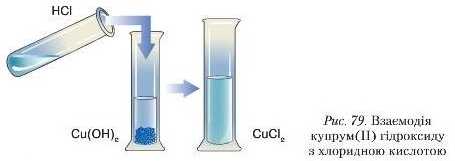
Ураховуючи те, що реакція нейтралізації характерна для кислот і основ, варто зазначити: усі основи (розчинні та нерозчинні у йоді) взаємодіють із розчинами кислот, а всі кислоти (розчинні та нерозчинні) — лише з лугами.
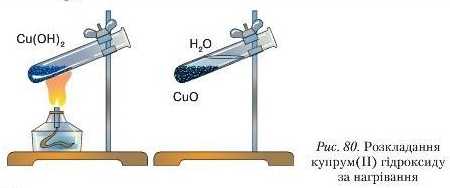
2. Розклад нерозчинних основ за нагрівання.
Дослідженнями доведено, що нерозчинні у воді основи за нагрівання легко розкладаються на відповідний оксид і воду. Це ще раз підтверджує, що ці сполуки є гідроксидами.
Проведемо дослід.
Д о с л ід 2. Добудемо і іерозч шп іу основу, я к он исаі ю в досліді 1. Свіжоосаджепий осад, що утворився на дні пробірки, нагріємо. Через кілька хвилин спостерігається зміна синього осаду на чорний (с. 180, рис. 80). Утворився кунрум(ІІ) оксид. Рівняння реакції:
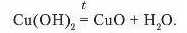
Отже, за нагрівання нерозчинні у воді основи розкладаються па відповідний оксид і воду.
ПІДСУМОВУЄМО ВИВ ПЕНЕ
• Спільні властивості основ зумовлені наявністю у їх складі гідро-ксид-іонів.
• Усі основи — тверді речовини. Луги — білого кольору, добре розчинні у воді. Нерозчинні основи мають різне забарвлення.
• Луги змінюють забарвлення індикаторів, вступають у хімічну взаємодію з кислотними оксидами, кислотами (реакція нейтралізації), розчинами солей.
• Реакції нейтралізації — це реакції між основою та кислотою з утворенням солі й води.
• Нерозчинні основи взаємодіють із кислотами та розкладаються за нагрівання на відповідний оксид і воду.
• Під час роботи з лугами й кислотами необхідно дотримуватися правил безпеки.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Випишіть формули основ із поданого переліку хімічних формул: FeO1 LiOH, Zn(OH)2, НСІ, K2O1 Mg(OH)2, H2SO4, NH4OH, CaO1 CaCO3, КОН, Fe(OH)3, Cr2O3, Ca(OH)2, HNO3, Ba(OH)2, AI2(SO4)3. Назвіть їх.
2. Сформулюйте визначення: а) основ; б) реакції нейтралізації.
3. Складіть формули гідроксидів за їх назвами: барій гідроксид, калій гідроксид, ферум(ІІ) гідроксид, магній гідроксид, купрум(ІІ) гідроксид, купрум(І) гідроксид, літій гідроксид.
4. Перетворіть схеми реакцій на рівняння, дописавши формули пропущених речовин і коефіцієнти: a) Ca(OH)2+ HCI -> ... + H2O;
б) CuSO4 + NaOH -> Cu(OH)2 + ...; в) KOH + SO3 -> ... + H2O;
г) NaOH + H2SO4= ... + H2O.
Укажіть реакції нейтралізації.
5. Розчин, що містив барій гідроксид масою 17,1 г, повністю нейтралізували розчином сульфатної кислоти. Обчисліть масу речовини, що випала в осад.
6. Через розчин, що містив кальцій гідроксид кількістю речовини 0,2 моль, пропустили сульфур(УІ) оксид до утворення кальцій сульфату. Обчисліть кількість речовини й масу утвореної солі.
7. Напишіть рівняння реакцій за поданими схемами.
а) КМПО4 —> О2~► BaO —> Ва(ОН)2~» BaSOii;
б) Н2О —> О2 —> CaO —> Са{0Н)2 —> СаСОз —> CaO.
' ЦІКАВО ЗНАТИ
• Нерозчинні у воді основи не змінюють забарвлення індикаторів.
• Луги можуть розкладатися лише за дуже високих температур.
ДОСЛІДЖУЄМО ВДОМА
Приготуйте розчин фенолфталеїну й універсальний індикаторний папір.
Дослід 1. Налийте по черзі на дно двох склянок вапняної води {гідроксид кальцію) та розчин нашатирного спирту. У першу склянку опустіть універсальний індикаторний папір, у другу — крапніть розчин фенолфталеїну. Поясніть спостережувані явища.
Дослід 2. Витисніть сік лимона й невеликими порціями доливайте його в першу склянку до відновлення попереднього забарвлення індикаторного паперу. Поясніть, яка реакція відбулася.
Дослід 3. Витисніть сік яблука. Долийте його в другу склянку. Поясніть спостережуване явище.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 19-09-2016, 00:09, Переглядів: 5074