§ 6. Періодичний закон Д. І. Менделєєва
Пригадайте: вищу валентність елементів можна визначити за номером групи Періодичної системи, у якій розташований елемент;
відрізнити метал від неметалу можна, ґрунтуючись на спільних фізичних властивостях металів: ковкість, металічний блиск, електропровідність, теплопровідність тощо;
як можна визначити хімічний характер оксидів (за § 1).
Відкриття Періодичного закону
На відміну від своїх попередників Д. І. Менделєєв був глибоко переконаний в існуванні природного взаємозв’язку між усіма хімічними елементами: як між подібними, так і між неподібними.
У середині XIX CT. було відомо близько 60 хімічних елементів. За основу їх систематизації Менделєєв обрав відносну7 атомну масу, вважаючи, що вона є головною характеристикою хімічного елемента: вона не змінюється при утворенні елементом простої або складної речовини.

Розташувавши в ряд символи всіх відомих на той час хімічних елементів у порядку зростання їхньої відносної атомної маси, він помітив, що елементи з подібними властивостями (наприклад, лужні елементи) не з’являються безпосередньо один за одним, а періодично (регулярно) повторюються.
Виявилося, що так само закономірно (через певний інтервал) повторюється хімічний характер сполук елементів.
Проаналізуємо, які закономірності можна виявити при розташуванні елементів у ряд (табл. З, с. ЗО).
Таблиця 3. Властивості хімічних елементів та їхніх сполук
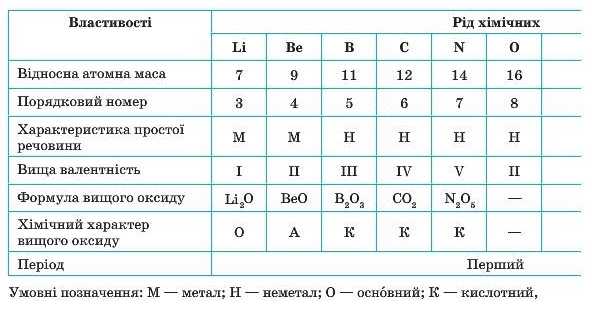
У ряду елементів, що наведені в таблиці 3, чітко простежується періодична зміна властивостей. Так, Літій утворює просту' речовину метал (лужний метал). Поступово характер простих речовин змінюється на неметалічний. Також поступово збільшується вища валентність, яку виявляють елементи, та хімічний характер їхнього оксиду. Літій оксид є основним, а Нітроген(У) оксид — кислотним (Оксиген і Флуор не здатні утворювати оксиди).
Далі ця послідовність у зміні властивостей різко обривається. З'являється елемент Натрій, який за своїми властивостями подібний до першого елемента ряду — Літію. У подальшому властивості елементів змінюються у такій самій послідовності, що й від Літію до Флуору. У ряду простих речовин відбувається поступова зміна: від типового металу (натрію) до типового неметалу (хлору). Спостерігається також зміна складу й характеру властивостей сполук, зокрема перехід від основного натрій оксиду до кислотного хлор(УІІ) оксиду.
Аналізуючи цю послідовність елементів, Д. І. Менделєєв виявив, що залежність властивостей елементів і їхніх сполук від атомної маси є періодичною. У 1869 р. він сформулював Періодичний закон.
Властивості хімічних елементів, а також утворених ними простих і складних речовин перебувають у періодичній залежності від відносних атомних мас елементів.
залежно від атомних мас
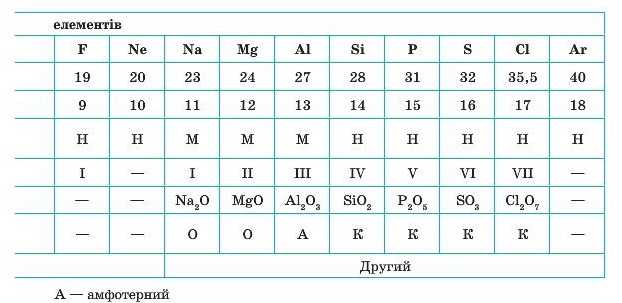
Розташовуючи відомі елементи за відносною атомною масою, Менделєєв помітив протиріччя між масою і розміщенням Аргону й Калію. Відносна атомна маса Калію дорівнює 39, а Аргону — 40. Якщо розташовувати їх за значенням відносних атомних мас, отримаємо:

Якщо ж всупереч атомним масам поміняти місцями Калій та Аргон, протиріччя зникає:

Цей парадокс із «хибним» розміщенням елементів був пояснений тільки на початку XX ст. після відкриття будови атома. Але
на той момент, без знань про будову атома, це був дуже сміливий вчинок. Якщо ви уважно розглянете сучасну Періодичну систему, то зможете знайти ще два приклади такого виняткового розташування хімічних елементів.
Початкове формулювання закону Д. І. Менделєєва було трохи іншим: «Властивості простих тіл, а також форма й властивості сполук елементів перебувають у періодичній залежності або, виражаючись алгебраїчно, утворюють періодичну функцію від величини атомних ваг елементів». У той час замість «речовина» говорили «тіло», а атомну масу називали атомною вагою.
L — _ — _ _ _ — — — — — — — — — — — — — β — — — — — — — — — — J
Від ряду елементів до Періодичної системи
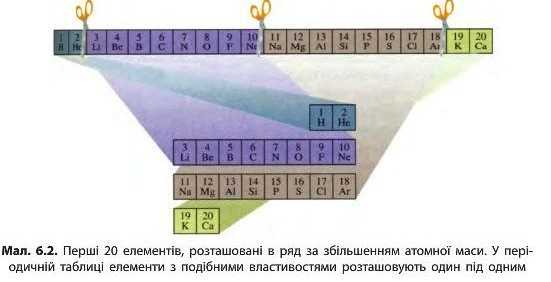
Отже, ряд хімічних елементів, розташованих за збільшенням їхніх відносних атомних мас, можна розділити на окремі дільниці. Кожна дільниця починається лужним елементом, а закінчується — інертним. Такі дільниці називають періодами. Періоди, розташовані один під одним, утворюють уже знайому вам періодичну таблицю хімічних елементів (мач. 6.2).
Ряд хімічних елементів, розташованих у порядку зростання їхніх атомних мас, що починається з Гідрогену або лужного металічного елемента і закінчується інертним елементом, називають періодом.
Властивості елементів, а також утворених ними простих речовин і сполук при збільшенні атомних мас у періоді поступово змінюються.
Перший період містить лише два елементи, другий і третій — по вісім. Ці періоди називають малими. У них при переході від Гідрогену або лужного металічного елемента до інертного елемента вища валентність елементів поступово зростає від І (у Гідрогену й лужних металічних елементів) до VII (у галогенів). Якби вдалося добути сполуки інертних елементів Неону й Аргону, то їхня максимальна валентність дорівнювала би VIII.
На відміну від перших трьох періодів четвертий і наступні періоди (п’ятий, шостий, сьомий) містять по 18 і більше елементів, тому їх називають великими.
У цих великих періодах також спостерігається поступова зміна властивостей. Але, якщо в малих періодах перехід від типового металічного елемента до типового неметалічного елемента відбувається за сім елементів, то у великих періодах такий самий перехід відбувається за 17 або 31 елемент. Тобто у великих періодах зміна властивостей відбувається значно повільніше: властивості сусідніх елементів у великих періодах відрізняються значно менше, ніж у сусідніх елементів малих періодів.
Поширена легенда, що думка про Періодичну систему прийшла до Менделєєва уві сні. Одного разу його запитали: чи це так, на що вчений відповів:
«Я над нею, може, двадцять років думав, а ви вважаєте: сидів і раптом... готово».
Висновки
1. Властивості хімічних елементів та утворених ними сполук перебувають у періодичній залежності від їхніх атомних мас. Усі хімічні елементи розділяють на періоди, кожний з яких починається лужним елементом (або Гідрогеном) і закінчується інертним елементом.
2. У періоді послаблюються металічні властивості і посилюються неме-талічні. Так само змінюється і характер сполук елементів: на початку періоду сполуки виявляють основні властивості, а на кінці періоду — кислотні.
Контрольні запитання
1. Сформулюйте Періодичний закон.
2. Які властивості елементів і їхніх сполук змінюються періодично?
3. Що називають періодом елементів?
4. Які періоди називають малими? великими? Чому їх називають саме так?
5. Чим відрізняється зміна властивостей елементів у великих та малих періодів?
6. У якій частині кожного періоду розташовані елементи, що відносяться до родин: а) лужних елементів; 6) галогенів; в) інертних елементів?
7. Для яких хімічних елементів найхарактернішими є властивості: а) металічні; б) неметалічні? Наведіть приклади.
Завдання для засвоєння матеріалу
1. Знайдіть у Періодичній системі елементи, що розміщені не за збільшенням їхньої відносної атомної маси. Які протиріччя з'являться, якщо їх розташувати згідно з їхніми атомними масами?
2. Як змінюється характер оксидів елементів у періоді? Проілюструйте рівняннями реакцій властивості оксидів Літію і Карбону. Які властивості характерні їхнім гідратам?
3. Складіть формули вищих оксидів і гідратів оксидів елементів третього періоду. Укажіть характер цих сполук (кислотний чи основний).
4. Елемент у Періодичній системі має порядковий номер 16. Які властивості виявляють його оксиди, що відповідають вищій й нижчій валентності? Чи утворює цей елемент сполуки з Гідрогеном?
5. Проаналізуйте положення в Періодичній системі елементів, що здатні утворювати леткі сполуки з Гідрогеном (див. форзац). Виявлення елементом яких властивостей свідчить про утворення ним летких сполук з Гідрогеном?
6. До кінця 60-х рр. XIX ст. два елементи — А і Б — вважалися двовалентними металічними елементами і ним приписувалися неправильні атомні маси. Не знайшовши для них у Періодичній системі місця, що відповідало б їхнім властивостям, Д. І. Менделєєв збільшив у півтора раза значення їхніх атомних мас і уточнив валентність кожного з них, і тоді місце їм знайшлося. Хибні атомні маси, що приписувалися елементам, були іакі: елеменіу А — близько 60, а елеменіу Б — ірохи більше за 90. Знайдіть їм місце в Періодичній системі і назвіть ці елементи.
7. Виконайте навчальний проект N0 1 «З історії відкриття Періодичної системи хімічних елементів».
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:45, Переглядів: 4015