Урок 14. Відносна молекулярна маса та відносна формульна маса
Мета: сформувати поняття про відносну молекулярну та відносну формульну маси; навчити обчислювати відносну молекулярну та відносну формульну маси.
Обладнання та матеріали: Періодична система хімічних елементів Д. І. Менделєєва.
Базові поняття та терміни: хімічний елемент, атом, молекула, формульна одиниця, відносна атомна маса, відносна молекулярна маса, відносна
формульна маса.
Тип уроку: комбінований.
Методи навчання: словесний: бесіда, розповідь; практичні: розв’язування вправ і задач, самостійна робота; репродуктивні, частково-пошукові, дослідницькі, інтерактивні, створення ситуації успіху.
Структура уроку
I. організаційний момент 1 хв
II. Актуалізація опорних знань 2 хв
III. Вивчення нового матеріалу 15 хв
1. Відносна молекулярна маса.
2. Відносна формульна маса.
IV. Закріплення знань 15 хв
V. Домашнє завдання 1 хв
VI. Підбиття підсумків уроку 2 хв
ХІД уроку
I. організаційний момент
Перевірка готовності учнів до уроку, налаштування на робочий настрій.
II. актуалізація опорних знань
; Бесіда
— З яких частинок можуть складатися речовини?
— Дайте визначення хімічної формули.
— Дайте визначення відносної атомної маси. Як вона обчислюється? Як позначається?
— Яку інформацію можна дізнатися з хімічної формули речовини?
Учитель зауважує, що за хімічною формулою речовини можна обчислювати масу молекул, і називає тему уроку. Учні самостійно формулюють мету уроку.
III. вивчення нового матеріалу
♦ Методична порада
Подання нового навчального матеріалу супроводжується виконанням завдань для формування вмінь обчислювати відносну молекулярну й відносну формульну маси. Завдання виконуються біля дошки та індивідуально в зошитах. Завдання слід заздалегідь підготувати на кожну парту або записати на дошці як план практичного опрацювання матеріалу.
1. Відносна молекулярна маса
; Розповідь учителя
Маси молекул, як і маси атомів, дуже малі. Тому для їх обчислення, як і для обчислення мас атомів, використовують порівняння з атомною одиницею маси.
Відносна молекулярна маса — це відношення маси молекули до 1/12 маси атома Карбону. Відносна молекулярна маса позначається — Мг. Вона показує, у скільки разів маса молекули більша за 1/12 маси атома Карбону, і як відносна атомна маса не має розмірності.
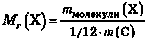
Відносна молекулярна маса дорівнює сумі відносних атомних мас усіх хімічних елементів, що містяться у складі молекули, з урахуванням числа атомів кожного елемента.
Наприклад, для молекули кисню, що складається з двох атомів Оксигену, маємо:
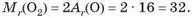
Молекула води Н20 складається з двох атомів Гідрогену й одного атома Оксигену. Отже, відносна молекулярна маса води дорівнює сумі двох відносних атомних мас Гідрогену й однієї відносної атомної маси Оксигену:
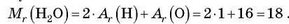
Аналогічно можна обчислити відносну молекулярну масу будь-якої речовини, якщо відома її хімічна формула. Наприклад, обчислимо відносні молекулярні маси азоту N0 та вуглекислого газу С02:
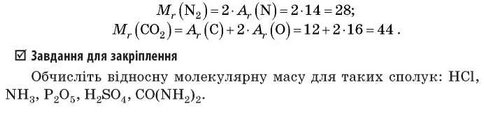
2. Відносна формульна маса (матеріал розглядається на розсуд учителя)
Розповідь учителя
Для речовин немолекулярної будови замість терміна «відносн молекулярна маса» використовують термін «відносна формульн маса». Але позначення і спосіб обчислення для цих величин є од наковими. Відносна формульна маса — це відносна маса формуль ної одиниці речовини. Вона може використовуватися для речовиі будь-якої будови.
Відносні формульні маси простих речовин немолекулярної бу дови, у складі яких містяться атоми тільки одного хімічного еле мента, прийнято вважати такими, що дорівнюють їхній відносні атомній масі, наприклад:
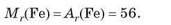
Відносні формульні маси простих йонів вважають таким, що дорівнюють відносній атомній масі (масою електронів нехтують):
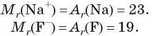
Відносні формульні маси складних йонів та йонних сполук обчислюють як відносні молекулярні маси.
Завдання для закріплення
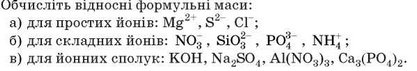
Слово вчителя
Використовуючи поняття «відносна формульна маса» та «відносна молекулярна маса», можна розв’язувати найпростіші задачі та визначати формули невідомих речовин.
Завдання для закріплення
Відносна молекулярна маса сполуки невідомого двовалентного елемента з Гідрогеном дорівнює 34. Визначте цей елемент і запишіть формулу сполуки.
(Заслуховуються пропозиції учнів, щодо розв’язування задачі. Учитель коригує й пояснює, як слід оформлювати розв’язок у зошиті.)
Слово вчителя
Знаючи відносну молекулярну масу, можна обчислити абсолютну масу молекули речовини Х (у грамах).
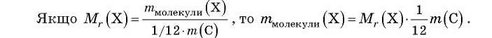
Обчисліть масу молекули води.
Якщо відносна молекулярна маса води дорівнює 18, то маса молекули води дорівнює:
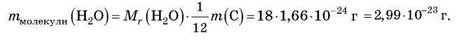
IV. ЗАКРІПЛЕННЯ ЗНАНЬ Завдання-гра
Цей етап уроку можна провести як самостійну роботу з елементами гри під девізом «Зрозумів сам, допоможи іншому».
І етап. Виконуються завдання на індивідуальних картках синього кольору (можна використовувати різнокольоровий папір для нотаток або звичайний папір із позначками відповідного кольору). Колір картки дозволяє вчителеві слідкувати за тим, на якому етапі працює кожний учень. Картки готуються для кожного учня. Завдання можна записати на дошці, а на картці записується номер варіанта та формули речовин для обчислення Мг. Завдання виконуються в зошитах. Для швидкої перевірки вчителеві необхідно підготувати контрольну картку з номерами варіантів і правильними відповідями.
Приклади завдань:
Обчисліть відносну формульну масу для таких сполук:

Учні, які першими завершать виконання завдань першого етапу, можуть допомагати своїм друзям. При цьому їм дозволяється вільно пересуватися по класу. Учителеві необхідно слідкувати, щоб допомога надавалася як пояснення, а не як виконання завдань друзів. За кожну надану консультацію учень отримує від учителя «фішку» (це можуть бути частинки якоїсь картинки, листівки, різнокольорові кружечки чи квадратики). Цей прийом дозволяє створити й підтримати ситуацію успіху.
II етап. Виконуються завдання на індивідуальних картках зеленого кольору. Картки також готуються для кожного учня і роздаються після виконання завдань першого етапу. Завдання виконуються в зошитах. Для швидкої перевірки вчителеві також необхідно мати контрольну картку з номерами варіантів і правильними відповідями.
Приклади завдань:
Обчисліть відносну формульну масу для таких сполук:

Учні, які першими завершують виконання завдань другого етапу, допомагають друзям і отримують додаткові «фішки» за кожну консультацію.
III етап. Виконується завдання на індивідуальних картках жовтого кольору. Завдання на цих картках мають бути більш різноплановими, це вже завдання на застосування знань. Кількість варіантів на цьому етапі може бути меншою, а завдання — подібними. Учні, які першими отримують картки на цьому етапі, виконують завдання на дошці. Завдання, що виконані на дошці, слід обговорити після завершення самостійної роботи.
Приклади завдань:
1. Яка з молекул важча: С12Н22011 чи С6Н6С16?
2. Обчисліть, що більше: маса п’яти молекул води Н20 чи трьох молекул вуглекислого газу С02.
3. Обчисліть, у скільки разів молекула вуглекислого газу С02 важча або легша за молекулу Н2.
4. Відносна молекулярна маса сполуки невідомого одновалентного елемента з Гідрогеном дорівнює 81. Визначте цей елемент і запишіть формулу сполуки.
5. Формула невідомої речовини Х203. Відносна молекулярна маса цієї речовини дорівнює 102. Визначте елемент X.
Учні, які виконали завдання третього етапу, допомагають друзям і отримують додаткові «фішки» за кожну консультацію або виконують завдання наступного етапу.
IV етап. Виконуються завдання на застосування знань у нестандартних ситуаціях. Усі завдання цього рівня подаються на однакових картках червоного кольору або записуються на дошці. Учень обирає для виконання тільки одне завдання. Завдання виконуються біля дошки й обговорюються в класі.
Приклади завдань:
1. У гідроген пероксиді на один атом Оксигену припадає один атом Гідрогену. Визначте хімічну формулу гідроген пероксиду, якщо його молекулярна маса дорівнює 34.
2. Речовина пірит складається з атомів Феруму та Сульфуру і має відносну молекулярну масу 120. Визначте хімічну формулу цієї речовини.
3. Жасмональ, що має запах квітів жасмину, має хімічну формулу С6Н5СНС(С5Н11)СНО. Обчисліть його відносну молекулярну масу. Переможцем гри вважається учень, який виконав завдання всіх
етапів і набрав найбільше число «фішок» за консультації. Йому надається звання «Експерт» і право перевіряти виконання завдань інших учнів на наступних уроках з цієї теми.
Якщо не вдалося розв’язати всі завдання III та IV етапів, до них слід повернутися на наступних уроках.
V. домашнє завдання
1. Прочитати параграф підручника.
2. Виконати завдання після параграфа.
VI. підбиття підсумків уроку
Учитель дякує консультантам за допомогу і просить учнів висловитися з приводу досягнення мети уроку.
Для підбиття підсумків цього уроку можна використати інтерактивну технологію колективно-групового навчання «Незакінчене речення».
Учитель пропонує учням продовжити речення: «Найважливішим на цьому уроці для мене було...» і радить говорити вільно, стисло й переконливо.
Автор: admin от 21-01-2017, 00:10, Переглядів: 6249