Хімічний зв'язок
Як утворюються сполуки?
Звичний для нас макросвіт складається з безлічі речовин і матеріалів, без яких ми не уявляємо сьогодні наше існування. Завдяки хімічним реакціям добувають ще більше речовин, корисних або шкідливих для црироди. Чому саме і як утворюються речовини? Для розуміння цього важливо знати певні закони й правила мікросвіту. А також, як і чому виникають хімічні зв’язки.
На кінець XX століття було відомо більше 19 млн сполук, з яких 12 млн — це органічні сполуки. І лише за 15 років XXI століття хіміки відкрили та синтезували їх більше 87 млн. Причину такого різноманіття сполук пояснюють властивостями атомів сполучатись з іншими атомами у різних співвідношеннях та комбінаціях.
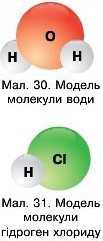
Розглянемо утворення молекул води (мал. ЗО) та гідроген хлориду IICl (мал. 31).
Пригадайте! Яка валентність в атомів Гідрогену, Оксигену та
Хлору у молекулах вода та гідроген хлориду (ПСІ).
Сполучення атомів у молекули відбувається за рахунок валентних електронів. Чому Оксиген маючи 6 зовнішніх електронів виявляє валентність II, а Хлор, що має 7 валентних електронів, виявляє у гідроген хлориді валентність І?
Пригадайте! Яка будова електронних оболонок атомів Гідрогену,
Оксигену та Хлору?
Валентність визначають кількістю валентних — не-сиарених електронів. Так, атом Гідрогену мае один несварений електрон на зовнішньому енергетичному рівні H Is1 (мал. 32), тому може проявляти валентність один.
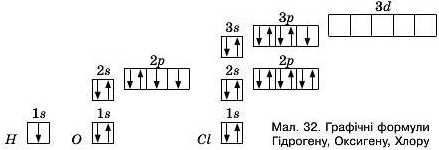
Атом Хлору (елемент 3 періоду) мае електронну формулу ls22s22pe3s23p6, отже теж має один несиарений електрон на зовнішньому енергетичному рівні. В атомі Оксигену (елемент VI групи) 6 зовнішніх валентних електронів, електронна формула ls22s22p4. Два неспа-рені електрони зовнішнього енергетичного рівня визначають його валентність.
Збуджений стан атома
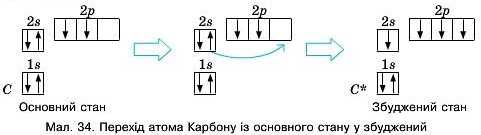
Метан CН4 є основною складовою нриродного газу. За його формулою слід сказати, що валентність Карбону становить чотири. Пригадаємо будову атома Карбону. Він має лише два неспарені електрони на зовнішньому енергетичному рівні (мал. 33). Щоб отримати чотири неспарені електрони для утворення чотирьох хімічних зв’язків у молекулі метану, необхідно один із спарених s-електронів перенести на вільну р-орбіталь. Цей процес відбувається коли йому передають деяку енергію. Атом переходить у збуджений стан і виявляє валентність чотири (мал. 34).
Отже, число неспарених електронів на зовнішньому енергетичному рівні дорівнює кількості утворених хімічних зв’язків, тобто— валентності атома.
Хімічний зв'язок — це взаємодія між структурними частинками: атомами, йонами, молекулами, що стало утримує їх у речовині.
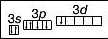
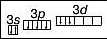
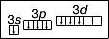
Хлор у сполуці з Гідрогеном виявляє нижчу валентність — І. Проте існують сполуки, де Хлор виявляє валентності III, V і вищу — УП. Це пов’язано із наявністю в атомі Хлору вакантної d-орбіталі. Тому атом Хлору може мати кілька збуджених станів. Під час поступового переходу електронів зовнішнього (третього) енергетичного рівня на </-орбіталі електронні формули мають такий вигляд:
|
|
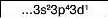 |
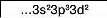 |
 |
|
Кількість неспарених електронів |
3 |
5 |
7 |
|
Графічна формула |
 |
 |
 |
Варто уточнити, що валентними є неснарені електрони або електрони, що можуть перейти на вільні (вакантні) орбіталі і, таким чином, стати неспареними. Атоми, що мають спарені чи неснарені електрони та вакантні орбіталі, вважають реакційноздатними, тобто здатними утворювати хімічні зв’язки.
Природа хімічного зв’язку
Сполучаючись, атоми намагаються набути стійкої конфігурації зовнішнього енергетичного рівня, подібно до інертних газів. Таку можливість вони мають якщо віддають у спільне користування, приєднують або притягують електрони інших атомів.
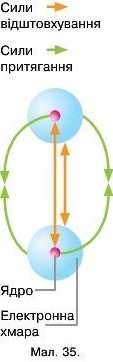
Якщо атоми електронейтральні за рахунок чого ж вони притягуються? Пригадаймо будову атома. У центрі атома розташоване ядро, оточене електронною оболонкою. У разі взаємодії двох атомів ядро першого атома притягує електрони другого і навпаки. З іншого боку взаємне відштовхування ядер не дає можливості частинкам сполучитись. Встановлюється певна рівновага між притяганням ядер і електронів та відштовхуванням двох ядер (мал. 35). Таким чином, природа хімічного зв’язку — електрична.
Від того яке ядро сильніше притягує зовнішні електрони іншого атома залежить тип взаємодії та тип зв’язку у сполуці. Силу, з якою атом певного елемента притягує електрони іншого атома визначають електро-негативністю.
Електронегативність елементів
Пригадайте! Яке число електронів міститься на зовнішньому енергетичному рівні в атомах металічних та неметалічних елементів?
З огляду на відмінності будови зовнішніх енергетичних рівнів металічних і неметалічних елементів у разі хімічної взаємодії атоми металічних елементів скоріше будуть віддавати електрони, а атоми неметалічних — їх притягувати чи приєднувати.
Електронегативність — це властивість атомів притягувати валентні електрони інших атомів.
У періодах зі збільшенням заряду ядра електроне-гативність зростає від лужних елементів до галогенів.
У кінці періодів розміщені благородні гази. їхні атоми мають завершені зовнішні енергетичні рівні — но 8 електронів, а для Гелію — 2. Це є стійка електронна конфігурація, тому ці елементи хімічно неактивні.
У групах зі збільшенням заряду ядра радіус атома збільшується значно стрімкіше, сила притягувати зовнішні електрони зменшується, отже і значення елек-тронегативності також зменшується. Ці залежності справедливі для елементів головних нідгрун, а для елементів побічних нідгрун існують додаткові умови.
Електронегативність величина відносна і безрозмірна. Найчастіше користуються значеннями електронегативностей, які запропонував американський фізик Лайнус Полінг. Її максимальне значення належить Флуору й дорівнює 4. Значення електронегативностей інших елементів менші за 4, наприклад: Гідроген 2,1, Хлор — 3,0, Бром — 2,8, Цезій — 0,7. Понят-гя електронегативності для інертних газів більшість вчених не застосовує.
Пам’ятайте! Складаючи хімічні формули, символи елементів з більшим значенням електронегативності записують на останньому місці: IIsS, IICl, NasSO4. Хоча є певні винятки: NII3. 3
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:46, Переглядів: 4154