Массовая доля элемента в веществе
Химическая формула вещества содержит определенную информацию. Она не только отображает качественный состав вещества (т. е. информацию о химических элементах, из которых она состоит), но и его количественный состав.
Например, в молекуле воды на два атома Гидрогена приходится один атом Оксигена. Суммарная относительная атомная масса атомов Гидрогена равна 2 (2 • АДЩ = 2 • 1 = 2), а относительная атомная масса атома Оксигена равна 16 (АДО) = 16). Следовательно, на 2 массовые части Гидрогена в воде приходится 16 массовых частей Оксигена.
Чтобы описать количественный состав веществ, используют массовую долю элемента в соединении, которую можно вычислить по химической формуле. Массовая доля элемента показывает, какая часть массы вещества приходится на атомы данного элемента. Ее вычисляют как отношение атомной массы данного элемента с учетом числа его атомов в молекуле к относительной молекулярной массе вещества:

Физическая суть массовой доли заключается в том, что она показывает массу атомов данного элемента в 100 г вещества. Массовая доля может выражаться в долях единицы или процентах. Чтобы перевести доли единицы в проценты, необходимо полученные по формуле значения умножить на 100 %. Сумма массовых долей всех элементов, которые входят в состав соединения, должна быть равна 1 или 100 %.
Пример 1. Вычислите массовые доли химических элементов в углекислом газе ТО2.
Решение:
Вычислим относительную молекулярную массу углекислого газа:

Сумма массовых долей Карбона и Оксигена в углекислом газе должна быть равна 1, поэтому массовую долю Оксигена можно определить, вычитая из единицы массовую долю Карбона:
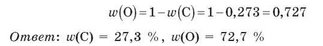
Пример 2. Вычислите массу атомов Оксигена, содержащихся в воде массой 1 кг.
Решение:
Вычислим массовую долю Оксигена в воде:
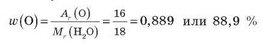
Массовая доля элемента показывает часть массы вещества, приходящуюся на данный элемент. Вычислим массу атомов Оксигена в воде массой 1 кг:
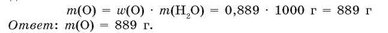
Законы Пруста и Дальтона
До начала XIX в. измерениям масс веществ не придавали особого значения и в науке бытовала мысль, что состав вещества может изменяться в зависимости от способа его получения.
Выдающийся французский химик, сын аптекаря. С 11 лет изучал аптекарское дело. В лаборатории своего отца в одиночестве любил смешивать реактивы, в результате чего чуть не отравился ядовитым газом. С 14 лет изучал химию в Париже. Был руководителем кафедры химии в университете Мадрида. Пруст проводил исследования в различных областях химии — минералогии, фармации, аналитической химии, изучал пороховые смеси. Он изобрел лекарство от цинги и некоторые пищевые добавки, разработал технологию выделения сахара из винограда и свеклы. Открыл закон постоянства состава веществ.

И действительно, почему соединение всегда должно содержать, скажем, 4 г элемента Х и 1 г элемента Y? Почему оно не может содержать 4,1 или 3,9 г Х? Но если материя состоит из атомов, то соединение образуется в результате соединения одного атома Х с одним атомом Y в одну молекулу, и никак иначе. В таком случае соотношения масс атомов Х и Y должны быть постоянными и ни от чего не зависеть.
Проведя многочисленные опыты, французский химик Ж. Л. Пруст доказал постоянство соотношений масс элементов в различных веществах. На основании своих экспериментов он сформулировал закон постоянства состава вещества, который утверждает, что любое вещество имеет постоянный состав независимо от способа его получения. Например, кислород можно получить разложением разных веществ, но его формула всегда будет одинаковой — О2.
Позднее Дж. Дальтон определил, что атомы разных элементов могут соединяться в разных соотношениях, но эти соотношения всегда кратны относительным атомным массам элементов. Например, атомы Карбона и Оксигена могут образовывать молекулы ТО (угарный газ) и ТО2 (углекислый газ). Но в этом случае образуются разные вещества, для каждого из которых характерно постоянство состава. Эти исследования Дальтона со временем оформились в закон кратных соотношений.
Выводы:
1. Химическая формула содержит информацию о количественном составе вещества. По химической формуле можно определить соотношение масс атомов разных химических элементов в веществе.
2. По химической формуле вычисляют массовую долю элемента в веществе как отношение массы атомов данного элемента к относительной молекулярной массе вещества. Массовая доля элемента показывает, какая часть массы вещества приходится на данный химический элемент.
Контрольные вопросы
1. Каким способом можно определить количественный состав веществ?
2. Как определяется массовая доля элемента в веществе? Приведите формулу для ее вычисления.
3. Какова физическая суть понятия «массовая доля элемента в веществе»?
4. Выберите правильные утверждения: а) по химической формуле можно узнать, какие химические элементы входят в состав вещества;
б) по химической формуле можно узнать соотношение атомов разных элементов в веществе; в) по химической формуле можно узнать, сколько атомов каждого элемента входит в состав молекулы вещества; г) по химической формуле можно узнать форму молекулы вещества.
5. Выберите правильный ответ. Массовая доля элемента в веществе показывает: а) во сколько раз масса одного атома больше массы молекулы; б) массу атомов данного химического элемента в 100 г вещества;
в) отношение массы атомов данного химического элемента к молекулярной массе; г) сколько атомов каждого элемента входит в состав молекулы.
Задания для усвоения материала
1. Вычислите массовые доли всех элементов в соединениях со следующими химическими формулами: а) N0.,; б) РЬС12; в) №2С03; г) H2SO4;
д) Ва^РО^.
2. Формула глюкозы С6Н1206, формула сахарозы С12Н22011. В каком веществе массовая доля Оксигена больше?
3. Вычислите массу атомов Гидрогена, которые содержатся в аммиаке NH3 массой 10 г.
4. Масса воды на Земле оценивается приблизительно в 1,45 • 1018 тонн. Вычислите, какая масса атомов Гидрогена и Оксигена содержится в этой массе воды.
По соотношениям масс атомов в XIX в. были определены химические формулы почти всех известных к тому времени веществ. Возможность выражения состава вещества простыми соотношениями стала одним из доказательств существования атомов.
Это материал учебника Химия 7 класс Григорович
Автор: admin от 19-01-2017, 03:22, Переглядів: 2956