§ 25. Молярная масса
Вспомните: физический смысл понятий «количество вещества» и «моль» (§ 24).
Взаимосвязь между массой и количеством вещества
Молекулы — это частицы с определенной, но очень маленькой массой. И если непосредственно измерить число молекул или количество вещества невозможно, то массу одного моля вещества измерить вполне реально. Такую массу называют молярной массой вещества.
Если мы знаем количество вещества n, которое содержится в том или ином образце, и массу образца m, то, разделив массу на количество вещества, получаем массу одного моля вещества, т. е. молярную массу:
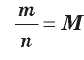
Молярная масса — это физическая величина, равная отношению массы вещества к его количеству.
Молярную массу обозначают буквой М и измеряют в граммах на моль (г/моль).
Поскольку для образца вещества количеством 1 моль масса будет равна молярной массе, то:
Молярная масса — это масса вещества количеством 1 моль.
Определение молярной массы вещества
Молярная масса М, выраженная в г/моль, численно равна относительной молекулярной массе Mr. Для простых веществ атомного строения молярная масса численно равна относительной атомной массе.
Хотя молярная масса M и относительная молекулярная масса Mr имеют одинаковые численные значения, между ними есть два существенных различия:
• молярная масса характеризует массу одного моля вещества, тогда как относительная молекулярная масса — массу одной молекулы;
• молярная масса не является относительной величиной и, в отличие от относительной молекулярной массы, имеет единицу измерения — г/моль.
Различные вещества состоят из разных молекул, имеющих разные массы. Если взять разные вещества в количестве 1 моль, легко заметить, что у них разная масса и они занимают разные объемы (рис. 25.1). Так, масса одного моля сахара — 342 г, а одного моля воды — 18 г. Это всего лишь две неполные столовые ложки. В чем же

тогда сходство этих образцов веществ? В них содержится приблизительно одинаковое число молекул, из которых они состоят. В двух столовых ложках (18 г) воды содержится столько же молекул воды H2O, сколько молекул сахарозы C12H22O11 в 342 г сахарного песка, а именно 6,02 · 1023 молекул.
Очевидно, что чем больше масса одной молекулы, тем больше молярная масса вещества.
Используя число Авогадро, легко доказать, что относительная молекулярная масса и молярная масса численно должны быть одинаковыми. Вещество количеством 1 моль содержит 6,02 · 1023 молекул, поэтому молярная масса (масса одного моля вещества) равна массе одной молекулы (в граммах), умноженной на постоянную Авогадро:

Массу молекулы можно также вычислить, зная относительную молекулярную массу Mr вещества:
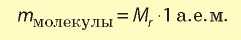
Если объединить эти два уравнения, помня, что произведение атомной единицы массы и числа Авогадро равно единице, получаем:
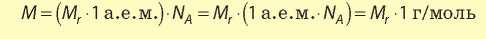

Расчеты с использованием молярной массы
Для того чтобы вычислить количество вещества, достаточно знать массу m этого вещества и его молярную массу М:
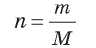
По этой формуле можно вычислить массу вещества в граммах:
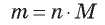
Наконец, если известны и масса, и количество вещества, то можно определить его молярную массу:
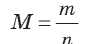
Все эти формулы используют для химических расчетов.
Задача 1. Вычислите молярную массу натрий карбоната Na2CO3. Решение:
Находим относительную молекулярную массу вещества:
Mr (Na2CO3) = 2 · Ar (Na) + Ar (C) + 3 · Ar (O) = 2 · 23 +12 + 3 16 = 106.
Молярная масса численно равна относительной молекулярной массе, следовательно: M(Na2CO3) = 106 г/моль.
Ответ: M(Na2CO3) = 106 г/моль.
Задача 2. Вычислите массу кальцинированной соды количеством вещества 0,5 моль.
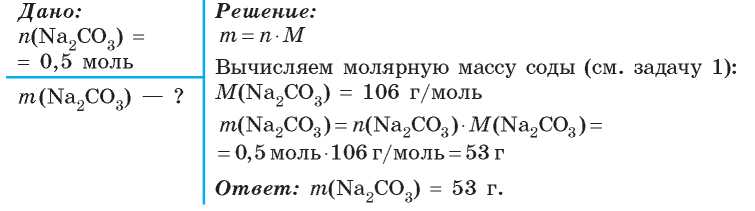
Задача 3. Какое количество вещества содержится в воде массой 1 кг?

Задача 4. Сколько атомов Сульфура содержится в образце серы массой 8 г?

Выводы
1. Молярная масса — это физическая величина, равная отношению массы вещества к его количеству. Молярная масса — это масса вещества количеством 1 моль.
2. Молярная масса вещества численно равна относительной молекулярной массе. Ее обозначают буквой М и измеряют в граммах на моль (г/моль).
Контрольные вопросы
1. Дайте определение молярной массы вещества.
2. В каких единицах измеряют молярную массу?
3. Как по химической формуле вещества определить его молярную массу?
4. Что общего и различного у понятий «молярная масса» и «относительная молекулярная масса»? Объясните на конкретных примерах.
Задания для усвоения материала
1. Молярная масса кислорода равна: а) 16 г/моль; б) 32 г/моль; в) 48 г/моль.
2. Вычислите массу: а) водорода количеством 2 моль; б) кислорода количеством 3 моль; в) воды количеством 5 моль.
3. Вычислите массу: а) 1,204 · 1022 атомов Цинка; б) 1,806 · 1024 молекул кислорода; в) 6,02 · 1021 молекул сульфатной кислоты H2SO4.
4. Вычислите молярные массы веществ по их формулам: H2S, NH3, F2, CaCO3, SO2, NaOH, K2SO4, Fe(NO3)3, NaAl(OH)4, CuSO4 · 5H2O.
5. Вычислите количество вещества: а) в 7 г железа; б) 21 г азота; в) 500 г мела CaCO3; г) 10 кг пищевой соды NaHCO3.
6. Какие массы воды, сахара C12H22O11, золота необходимо взять, чтобы каждого вещества было по 5 моль?
7. Вычислите молярную массу простого вещества, если: а) масса 7 моль его равна 444,5 г; б) масса 3,5 моль — 84 г; в) масса 0,25 моль — 8 г. Назовите эти вещества.
8. Определите, масса какого из образцов веществ больше: а) 3 моль кислорода или 2 моль азота; б) 5 моль воды или 1,4 моль хлора; в) 1 моль негашеной извести CaO или 1 моль жженой магнезии MgO?
9. Сколько молекул воды содержится в стакане объемом 200 мл?
10. Вычислите количество вещества и число атомов Оксигена, которые содержатся: а) в 3 моль сернистого газа SO2; б) 40 г медной окалины CuO.
11. Образец нитратной кислоты HNO3 имеет массу 122 г. Вычислите в этом образце количество вещества: а) нитратной кислоты; б) атомов Нитрогена; в) атомов Гидрогена; г) атомов Оксигена.
12. Образец соединения Карбона с Гидрогеном массой 0,8 г содержит 0,05 моль вещества. Вычислите молярную массу этого вещества и определите его формулу.
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:38, Переглядів: 3916