Молекулярний рівень організації життя: органічні та неорганічні речовини
Елементарний склад живих організмів
У складі живих організмів є ті самі хімічні елементи, що складають об’єкти неживої природи . Проте співвідношення елементів у живому та неживому неоднакове . Живі організми на 98 % складаються з Карбону, Гідрогену, Оксигену та Нітрогену Хімічні елементи, які входять до складу клітин і виконують біологічні функції, називаються біогенними.
|
Хімічні елементи (за кількісним складом) |
 |
|
Речовини клітини |
 |
Елементи, що входять до складу живих організмів
|
Елемент |
Символ |
Вміст (%) |
Значення для клітини й організму |
|
Карбон |
с |
15—18 |
Головний структурний компонент всіх органічних сполук клітини |
|
Оксиген |
О |
65—75 |
Головний структурний компонент всіх органічних сполук клітини |
|
Нітроген |
N |
1,5— 3,0 |
Обов’язковий компонент амінокислот |
|
Гідроген |
H |
8—10 |
Головний структурний компонент всіх органічних сполук клітини |
|
Фосфор |
P |
0,0001 |
Входить до складу кісткової тканини і зубної емалі, нуклеїнових кислот, АТФ і деяких ферментів |
|
Калій |
K |
0,15—0,4 |
Міститься в клітині тільки у вигляді йонів, активує ферменти білкового синтезу, обумовлює ритм серцевої діяльності, бере участь у процесах фотосинтезу |
|
Сульфур |
S |
0,15—0,20 |
Входить до складу деяких амінокислот, ферментів, вітаміну В |
|
Хлор |
Cl |
0,05—0,10 |
Найважливіший аніон в організмі тварин, компонент HCl у шлунковому соку |
|
Кальцій |
Ca |
0,04—2,00 |
Входить до складу клітинної стінки рослин, кісток і зубів; активує згортання крові й скорочення м’язових волокон |
|
Магній |
Mg |
0,02—0,03 |
Входить до складу молекул хлорофілу, а також кісток і зубів, активує енергетичний обмін і синтез ДНК |
|
Натрій |
Na |
0,02—0,03 |
Міститься в клітині тільки у вигляді йонів, обумовлює нормальний ритм серцевої діяльності, впливає на синтез гормонів |
|
Ферум |
Fe |
0,010—0,015 |
Входить до складу багатьох ферментів, гемоглобіну і міоглобіну, бере участь у біосинтезі хлорофілу, у процесах дихання і фотосинтезу |
|
Іод |
I |
0,0001 |
Входить до складу гормонів щитоподібної залози |
|
Купрум |
Cu |
0,0002 |
Входить до складу деяких ферментів, бере участь у процесах кровотворення, фотосинтезу, синтезу гемоглобіну |
|
Манган |
Mn |
0,0001 |
Входить до складу деяких ферментів або підвищує їх активність, бере участь у розвитку кісток, асиміляції азоту й процесі фотосинтезу |
|
Молібден |
Mo |
0,0001 |
Входить до складу деяких ферментів, бере участь у процесах зв’язування атмосферного азоту рослинами |
|
Кобальт |
Co |
0,0001 |
Входить до складу вітаміну Б,, бере участь у фіксації атмосферного азоту рослинами, розвитку еритроцитів |
|
Цинк |
Zn |
0,0003 |
Входить до складу деяких ферментів, бере участь у синтезі рослинних гормонів (фуксину) і спиртовому бродінні |
|
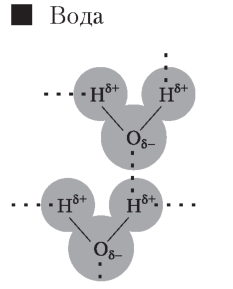
Молекула води (H2O) полярна . її різні полюси мають частково позитивні і негативні заряди . У цілому молекула води електронейтральна . Сусідні молекули води можуть притягуватись одна до одної за рахунок сил електростатичної взаємодії між негативним зарядом на |
атомі Оксигену однієї молекули та позитивним зарядом на атомі Гідрогену іншої . Такий тип зв’язку називається водневим . Водневий зв’язок обумовлює відносно високі температури кипіння, плавлення та випаровування |
|
Значення води |
|
|
1. |
Вода — універсальний розчинник . За розчинністю у воді речовини поділяються на гідрофільні (добре розчинні) та гідрофобні (нерозчинні) |
|
2 . |
Вода визначає деякі фізичні властивості клітин — їхній об’єм, внутрішній тиск (тургор) . |
|
3 . |
Вода — середовище для фізіологічних і біологічних процесів . Розщеплення багатьох речовин відбувається за рахунок їх взаємодії з водою, каталізуємої ферментами . Такі реакції називаються реакціями гідролізу |
|
4 . |
Вода — терморегулятор . Вона має велику теплоємкість, тобто здатна поглинати тепло без значних змін своєї температури |
|
5 . |
Вода — основне середовище пересування речовин в організмі та клітині |
|
До неорганічних речовин клітини належать мінеральні сполуки — солі Натрію, Калію, Кальцію та ін . |
В організмі солі перебувають або в іонному стані, або у вигляді твердих сполук |
Найбільш поширені йони живих організмів
|
Катіони |
Аніони |
|
H+ — Гідрогену |
OH — гідроксилу |
|
K+ — Калію |
Cl-— хлоридної кислоти |
|
Na+ — Натрію |
HSO-1 SQ2-— сульфатної кислоти |
|
Ca2+ — Кальцію |
H2PO-l .. HPQ2- г — фосфатної кислоти |
|
Mg2+ — Магнію |
HCO- — карбонатної кислоти |
Органічні речовини
|
Органічні речовини — сполуки, молекули котрих утворені ланцюгами з ковалентно зв’язаних атомів Карбону. Макромолекули — відносно великі молекули з високою молекулярною масою . Такі молекули складаються з подібних за структурою низькомоле |
кулярних сполук, які повторюються й ковалентно зв’язані між собою . Утворена мономерами макромолекула називається полімером . Серед органічних речовин клітини макромолекулами є полісахариди, білкові молекули, нуклеїнові кислоти . |
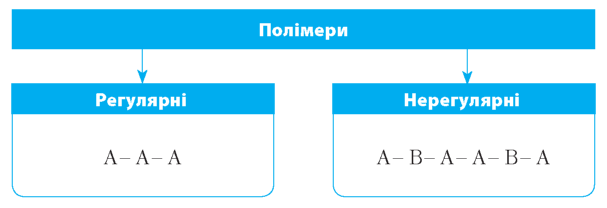 |
Регулярними біополімерами є, наприклад, крохмаль, глікоген, целюлоза . Нерегулярними — білки та нуклеїнові кислоти . |
Вуглеводи
|
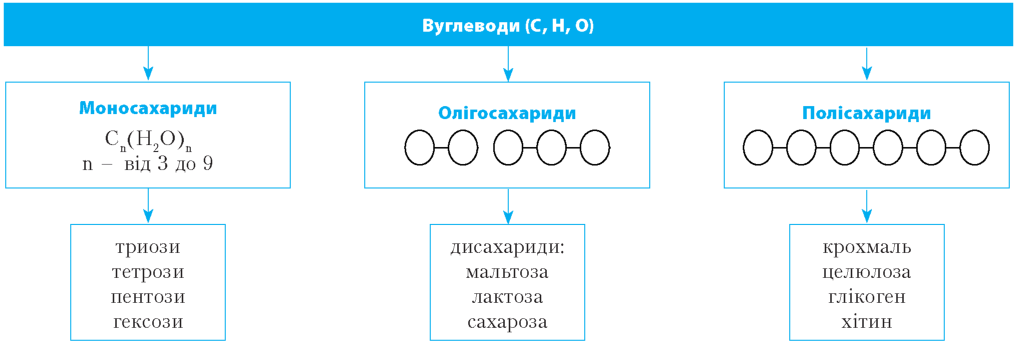
молекули вуглеводів побудовані з трьох елементів — Карбону, Ок-сигену і Гідрогену. Вуглеводи — основне джерело енергії для живих організмів Рослини синтезують вуглеводи в процесі фотосинтезу. |
Вміст вуглеводів у клітинах тварин рідко перевищує 5 %, але в клітинах рослин може досягати 90 % від загальної кількості органічних молекул |
|
Моносахариди, або прості цукри,— сполуки з емпіричною формулою Cn(H2O)n, які не гідролізуються . Це тверді кристалічні речовини, розчинні у воді, мають солодкий смак . За кількістю атомів Карбону моносахариди поділяються: на тріози C3H6O3 — молочна та піровиноградні кислоти, проміжні продукти вуглеводного обміну; |
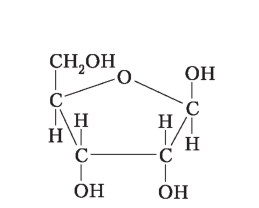
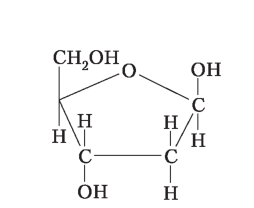
тетрози C4H8O4 — зустрічаються рідко, частіше в бактерій; пентози C5H10O5 — рибоза, входить до складу РНК; C5H10O4 — дезоксирибоза, входить до складу ДНК; гексози C6H12O6 — глюкоза, фруктоза, галактоза |
 |
 |
 |
 |
|
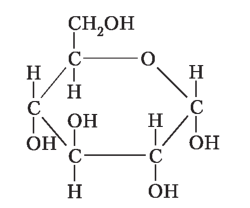
Глюкоза |
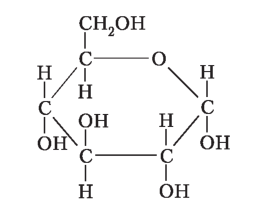
Фруктоза |
Рибоза |
Дезоксирибоза |
|
Глюкоза — первинне джерело енергії для клітин . Вона обов’язково входить до складу майже всіх клітин, органів і тканин, регулює осмотичний тиск Зниження рівня глюкози в крові призводить до по |
рушення життєдіяльності нервових та м’язових клітин У розчинах глюкоза існує в циклічній та лінійній формах, між якими встановлюється хімічна рівновага . |
Лінійна та циклічні форми глюкози
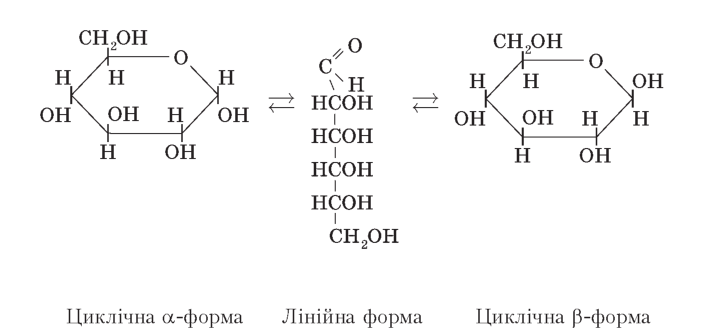
|
Дисахариди - вуглеводи, молекули яких складаються з двох молекул моносахаридів . Мають |
приємний солодкий смак, добре розчиняються у воді . |
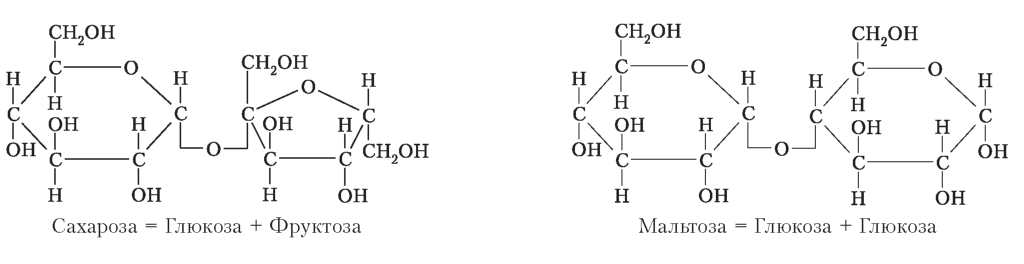
|
Полісахариди складаються з великої кількості моносахаридів . Відрізняються між собою складом мономерів, довжиною та ступе- |
нем розгалуженості Полісахариди майже не розчиняються у воді й не мають солодкого смаку |
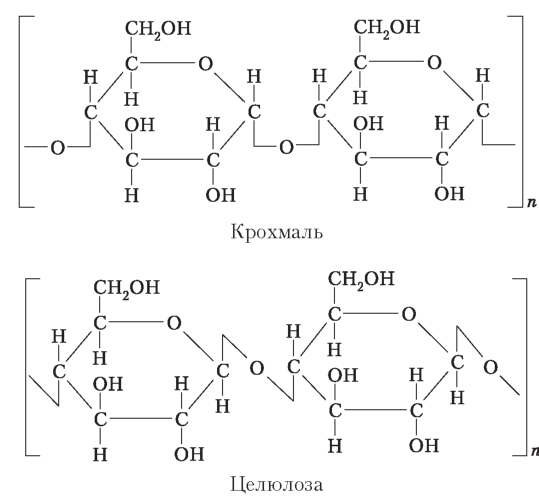 |
|
Полісахариди (за складом) |
Гетерополісахариди (різні види моносахаридів)
Гомополісахариди (один вид моносахаридів)
|
Функція |
Характеристика |
|
Енергетична |
Основне джерело енергії . Розщеплюються до моносахаридів із наступним окиснен-ням до СО2 та Н2О . При розщепленні 1 г вуглеводів виділяється 17,6 кДж енергії |
|
Структурна |
Входять до складу оболонок клітин і деяких органел . У рослин полісахариди виконують опорну функцію |
|
Запасаюча |
Накопичуються в тканинах рослин (крохмаль) та тварин (глікоген) . Використовуються при виникненні потреби в енергії |
|
Захисна |
Секрети, що виділяються різними залозами, збагачені вуглеводами, наприклад глюкопротеїдами, які захищають стінки полих органів (стравохід, шлунок, бронхи) від механічних пошкоджень, проникнення шкідливих бактерій та вірусів |
Ліпіди
|
Ліпіди — нерозчинні у воді, але добре розчинні в неполярних ре- |
човинах (ефірі, ацетоні тощо) органічні сполуки |
Ліпіди
|
Жири |
Жироподібні речовини: фосфоліпіди, гліколіпі-ди, стероїди, ліпопротеїди, воски, жирні кислоти |
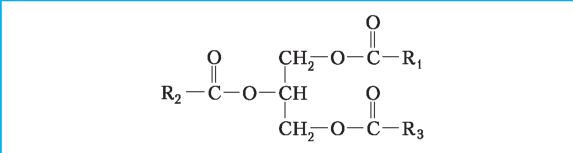 |
Найпоширенішими сполуками серед ліпідів є жири, до складу яких входять трьохатомний спирт гліцерин і залишки жирних кислот |
|
Схема будови молекули жиру: R1, R2, R3 — залишки жирних кислот, за якими відрізняються різні жири |
Жири
|
Тверді |
Рідкі |
|
|
Переважно тваринні жири . У складі молекул більше насичених жирних кислот |
Переважно рослинні жири . У складі молекул багато нена-сичених жирних кислот |
|
Функція |
Характеристика |
|
Енергетична |
При повному окисненні 1 г жиру виділяється 38,9 кДж енергії |
|
Запасаюча |
Жири відкладаються у тканинах, формуючи резервні енергетичні запаси . Запаси жирів можуть бути джерелом метаболічної води (у верблюдів) |
|
Захисна |
Жирові відкладення захищають організм та внутрішні органи від механічних пошкоджень |
|
Теплоізолююча |
Жирові відкладення, підшкірна жирова клітковина запобігає тепловим утратам |
|
Будова і функції жироподібних речовин |
|
|
Фосфоліпіди - |
містять залишок фосфорної кислоти, входять до складу клітинних мембран |
|
Гліколіпіди - |
сполуки ліпідів з вуглеводами . Є складовою частиною тканин мозку та нервових волокон |
|
Ліпопротеїди - |
комплексні сполуки різноманітних білків із жирами |
|
Стероїди - |
важливі компоненти статевих гормонів, вітаміну D |
|
Воски - |
виконують захисну функцію: у ссавців змащують шкіру і волосся, у птахів надають пір’ю водовідштовхувальних властивостей, у рослин запобігають надмірному випаровуванню води |
Білки
|
Білки - високомолекулярні нерегулярні гетерополімери, мономерами яких є амінокислоти |
До складу білків входять 20 різних амінокислот. |
Амінокислоти - структурні мономери білків
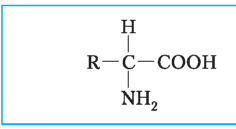 |
Схема будови молекули амінокислоти: R - амінокислотний радикал, за яким відрізняються різні амінокислоти |
|
Амінокислоти сполучаються між собою ковалентним зв’язком між карбоксильною групою однієї амінокислоти та аміногру |
пою іншої . Такий зв’язок називається пептидним . Амінокислоти об’єднуються за допомогою пеп-тидних зв’язків у пептиди . |
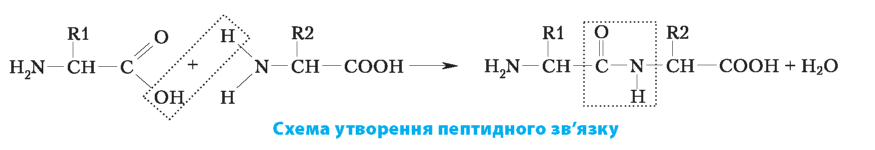
Функціональні властивості білків зумовлені послідовністю амінокислотних залишків і просторовою структурою поліпептидного ланцюга
|
Прості (протеїни) |
Складні (протеїди) |
|
|
Складаються тільки з амінокислот j |
Складаються з амінокислот та речовин небілкової природи V |
|
Структура |
Характеристика |
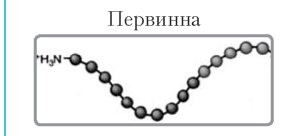 |
Визначається порядком чергування амінокислот у пептидному ланцюзі . Амінокислоти з’єднуються міцним пептидним зв’язком |
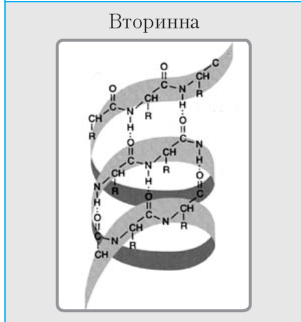 |
Спірально-закручений білковий ланцюжок Витки спіралі утримуються водневими зв’язками між СО- і NH-групами, розташованими на сусідніх витках |
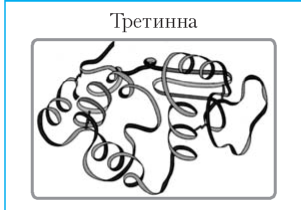 |
Виникає внаслідок закручування вторинної структури в клубок (глобулу) . Клубок утримується гідрофобними, іонними та водневими взаємодіями |
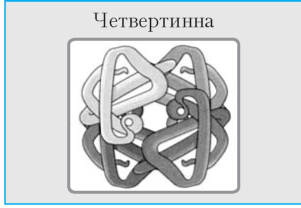 |
Формується кількома глобулами білка . Стійку конфігурацію утворюють гідрофобні, електростатичні та водневі зв’язки |
Порушення природної структури білків
|
Під впливом різних фізико-хімічних чинників (дія концентрованих кислот і лугів, важких металів, високої температури тощо) структура та властивості білків можуть змінюватися . Процес порушення природної структури білка або розгортання поліпептидного ланцюга без руйнування пептидних зв’язків називається денатурацією |
Денатурація має необоротний характер . Однак на перших стадіях, за умов припинення дії негативних чинників, білок може відновлювати свій нормальний стан (ренату-рація) . Процес руйнування первинної структури білків завжди необоротний, він називається деструкцією |
|
Функція |
Характеристика |
|
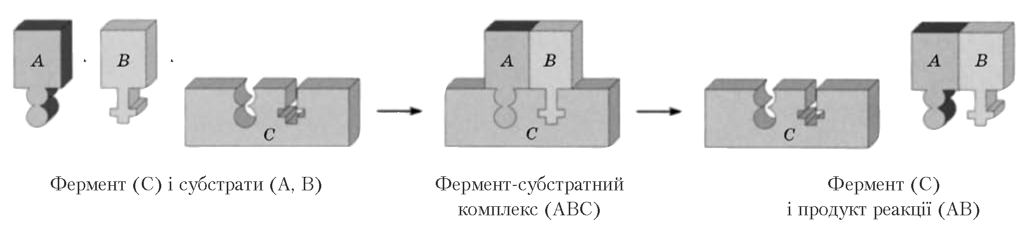
Ферментативна (біокаталіз) |
Ферменти забезпечують проходження хімічних реакцій у клітині за низьких температур, невисокого тиску і дуже малих концентрацій |
|
Будівна (структурна) |
Основний будівний матеріал клітини (мембран, органоїдів) |
|
Захисна |
Білки-антитіла здатні «розрізнювати» і знищувати хвороботворні мікроорганізми . Білки ядра гістони захищають молекули ДНК від ушкоджень . Білкові фактори згортання крові захищають організм від крововтрат |
|
Регуляторна (гуморальна, гормональна) |
Поряд із нервовою системою гормони білкової природи керують роботою різних органів і всього організму через систему хімічних реакцій |
|
Сигнальна |
Окремі білки клітинних мембран здійснюють прийом сигналів і передачу їх всередину клітини |
|
Скорочувальна (рухова) |
Усі види рухів виробляються особливими видами скорочувальних білків |
|
Транспортна |
Транспортні білки крові переносять кисень та органічні речовини |
|
Енергетична |
При окисненні 1 г білка вивільняється 17,2 кДж енергії |
Нуклеїнові кислоти
|
У 1868 р . швейцарський лікар І . Ф . Мішер виявив у ядрах лейкоцитів, що входять до складу гною, речовини кислотної природи, які він назвав нуклеїновими кислота |
ми (від латин . nucleus — ядро) . Згодом нуклеїнові кислоти були виявлені у всіх рослинних і тваринних клітинах, вірусах, бактеріях і грибах |
|
Нуклеїнові кислоти — складні ви-сокомолекулярні біополімери, мономерами яких є нуклеотиди . |
У клітинах присутні дизоксирибо-нуклеїнові (ДНК) та рибонуклеїнові (РНК) кислоти . |
|
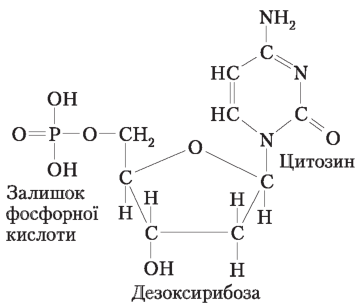
Молекула нуклеотиду складається з трьох частин — азотистої основи, моносахариду (пентози) та залишку фосфорної кислоти |
|
Залежно від виду пентози в складі нуклеотиду розрізняють дезоксирибонуклеїнові кислоти (ДНК), до складу яких входять залишки дезоксирибози, та рибонуклеїнові кислоти (РНК), які містять залишки рибози |
|
У молекулах ДНК і РНК є залишки азотистих основ: аденіну (А), гуаніну (Г), цитозину (Ц) . Крім того, до складу ДНК входить залишок тиміну (Т), а РНК — урацилу (У) . Таким чином, три типи азотистих основ у ДНК і РНК спільні, а за четвертими розрізняються |
Будова молекули нуклеїнової кислоти
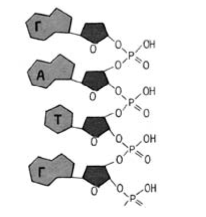 |
Окремі нуклеотиди сполучаються між собою у ланцюг за допомогою особливих «містків», які виникають між залишками пентоз двох сусідніх нуклеотидів за участю залишків фосфорної кислоти |
Нуклеїновим кислотам притаманна первинна структура — певна послідовність розташування нук-леотидів, а також складніша просторова будова, яка формується за рахунок водневих зв’язків . |
Нуклеїнові кислоти
|
ДНК |
РНК |
|
|
Містяться в ядрі, мітохондріях і пластидах Носій спадкової інформації |
Містяться в ядрі, цитоплазмі, мітохондріях і пластидах. Беруть участь у біосинтезі білка |
 |
Інформаційна (іРНК) |
Становить собою копію певної ділянки молекули ДНК і переносить генетичну інформацію від ДНК до місця синтезу поліпептидного ланцюга . Молекула нестабільна і швидко розпадається на нуклеотиди |
|
Транспортна (тРНК) |
Приєднує амінокислоти, транспортує їх до місця синтезу білкових молекул Кожна з амінокислот транспортується своєю тРНК . Має постійну вторинну структуру у формі листка конюшини |
|
|
Рибосомальна (рРНК) |
Взаємодіючи з рибосомальними білками, забезпечує певне просторове розташування іРНК і тРНК на рибосомі, виконуючи структурну функцію |
|
У 1953 р. англійські вчені Дж. Уотсон і Ф. Крик запропонували модель просторової структури ДНК Вони показали, що ДНК складається з двох полінуклеотидних ланцюгів, спірально закручених один навколо іншого Подвійна спіраль стабілізована водневими зв’язками між азотистими основами різних ланцюгів так, що проти аденіну одного ланцюга завжди стоїть тимін іншого, а проти гуаніну — цитозин . Багато- |
разове повторення цих зв’язків надає великої стійкості подвійній спіралі ДНК. За певних умов (дія кислот, лугів, нагрівання тощо) відбувається денатурація ДНК — розрив водневих зв’язків між комплементарними азотистими основами Денатурована ДНК може відновити двоспіральну будову завдяки встановленню водневих зв’язків між комплементарними нуклеотидами — цей процес називається ренатурацією |

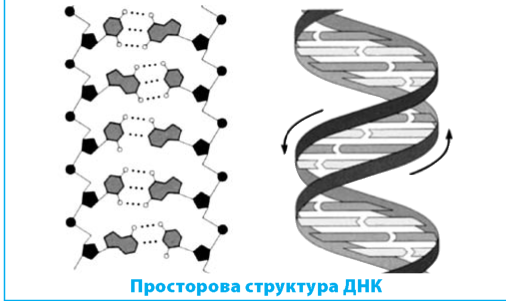 |
Чітка відповідність нуклеотидів у двох ланцюгах ДНК називається комплементарністю Відстань між сусідніми азотистими основами становить 0,34 нм, крок спіралі містить 10 пар основ і дорівнює 3,4 нм, а її діаметр — близько 2 нм . |
|
Принцип комплементарності лежить в основі здатності молекули |
ДНК до реплікації — самоподвоєн-ня |
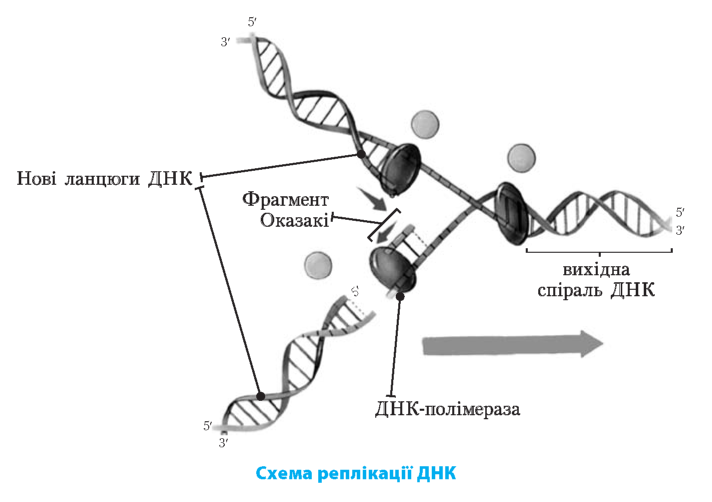
Реплікація ДНК
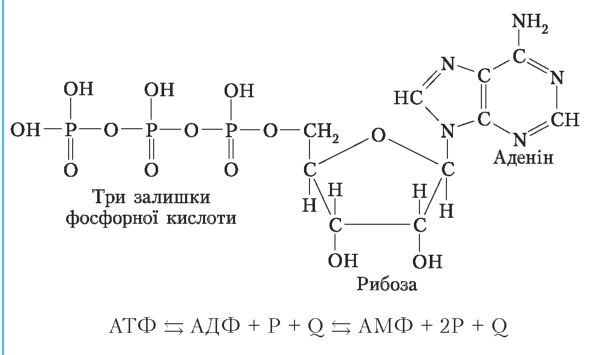 |
Аденозинтрифосфорна кислота (АТФ) — нуклеотид, до складу якого входить азотиста основа аденін, вуглевод рибоза і три залишки фосфорної кислоти Молекула АТФ є універсальним хімічним акумулятором енергії в клітинах Залишки фосфорної кислоти зв’язані макроергічними зв’язками . Коли від АТФ відщеплюється один залишок фосфорної кислоти, утворюється АДФ — аденозиндифосфорна кислота та виділяється 40 кДж енергії |
Автор: admin от 23-06-2013, 13:48, Переглядів: 6753