Оксиди
Важко переоцінити значення речовин, які розглянемо в цьому параграфі, для людей і нашої планети. Там, де немає цих речовин, — немає життя. Цей клас сполук є основою багатьох мінералів, руд, він входить до складу глини. Оксидом можна вважати й найцінніший мінерал нашої планети — воду.
Поширенші оксидів у природі
У повітрі е вуглекислий газ CO2, сульфур(ІУ) оксид SO2, нітроген(ІІ) оксид N0, які з’явились внаслідок вулканічної та антропогенної діяльності.

У земній корі оксиди трапляються у вигляді мінералів: кварц (гірський кришталь) SiO2, гематит Fe2Oa, корунд Al2O3Ta багато інших сполук. Силіцій оксид — це складова піску, алюміній оксид Al2O3 — основна складова глини й дорогоцінного каміння: рубінів, сапфірів.
З природних оксидів Феруму, Манґану, Хрому, Стану му виплавляють відповідні метали.
Наявність оксидів у космосі доведено дослідженнями доступних планет. Так, атмосфера Венери склада-
ється з вуглекислого газу. Дослідження ґрунту Марса (мал. 56), який ще називають Червоною планетою, по-казали, що до його складу також входить кварц SiO2, гематит Fe2O3 та інші сполуки. Якраз останній і обумовлює червоно-бурий колір планети.
Оксиди — бінарні сполуки елементів з Оксигеном, що має ступінь окиснення (-2).
Назви оксидів
Для утворення назви оксиду за його формулою спочатку потрібно дати назву елемента в називному відмінку, вказати його валентність у даній сполуці (якщо вона змінна), потім додати слово «оксид». Наприклад:
Na2O — натрій оксид, AI2Oa — алюміній оксид, Cl2O — хлор(І) оксид, WO3 — вольфрам(Л'І) оксид.
Класифікація оксидів
Для утворення назв оксидів елементів із змінною валентністю часто використовують інший підхід — числівникові префікси:
CI2O — дихлор моноок-сид, WO3 — вольфрам триоксид.
Оксиди утворюють усі елементи, за винятком благородних газів, тобто усі металічні й неметалічні елементи. Більшість елементів має змінну валентність й утворює кілька оксидів.
Неметалічні елементи утворюють кислотні оксиди. Виняток становлять оксиди: карбон(ІІ) оксид, HiTporeH(I) оксид, нітроген(ІІ) оксид, силіцій(П) оксид.
Пам’ятайте! До кислотних оксидів ПЕ відносять: CO, NtO, NO, SiO.
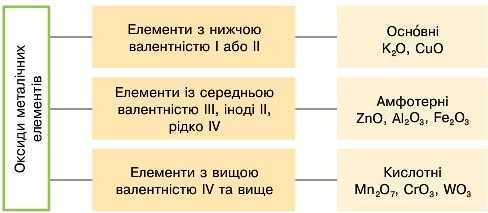
Металічні елементи можуть утворювати основні, амфотерні та кислотні оксиди. Це пояснюється тим, що більшість металічних елементів має змінну валентність, що й обумовлює різний характер їхніх оксидів.

Хром утворює оксиди CrO — кристали чорно-коричневого кольору, CrOi — чорного, CrsO3 — зеленого, CrO3 — темно-червоного. Складіть назви цих оксидів.

Фізичні властивості й агрегатний стан оксидів
Основні оксиди — це йонні сполуки, що за стандартних умов неребувають у твердому стані, мають високі температури плавлення. Наприклад, магній оксид —
+2825 °С, ферум(П) оксид — +1377 °С.
Основні оксиди мають різне забарвлення: негашене ванно — кальцій оксид — білого кольору, куирум(ІГ) оксид — чорного, меркурій(ІІ) оксид — червоного або жовтого кольору. Основні оксиди нелеткі, тому не мають запаху. Більшість з них не розчиняються у воді. Але деякі оксиди реагують з водою.
Кислотні оксиди можуть бути молекулярної та немолекулярної будови, тому їхні агрегатні стани за стандартних умов різні.
Кислотні оксиди молекулярної будови можуть бути твердими речовинами — фосфор(У) оксид, рідинами — сульфур(УІ) оксид, нітроген(Ш) оксид, або газами — карбон(ІУ) оксид, нітроген(ІУ) оксид. Температури плавлення й кипіння таких оксидів невисокі. Деякі з них леткі та мають запах. Газу ваті оксиди переважно безбарвні. Але трапляються й забарвлені. Так, нітроген(ІУ) оксид називають «бурим газом», бо він має червоно-буре забарвлення, хлор(І) оксид — газ жовтого кольору. Рідкий нітроген(ІП) оксид — синього кольору.
Газуваті оксиди можуть бути легші (CO) й важчі за повітря (NO2).

Деякі кислотні оксиди немолекулярної будови — тверді речовини. Відиовідно і температури кипіння й плавлення цих оксидів високі. Наприклад, вольфрам(УІ) оксид має температуру плавлення +1470 °С, силіцій(ГУ) оксид (+1610 °С).
Серед твердих кислотних оксидів більшість безбарвні. Але існують і забарвлені — вольфрам(УЇ) оксид має голчасті кристали жовтого кольору.
Амфотерні оксиди — тверді сполуки йонної будови з високими температурами плавлення й кипіння, нерозчинні у воді, різного забарвлення. Алюміній оксид і цинк оксид — білого кольору, ферум(Ш) оксид — бурого (складова іржі), хром(ІІГ) оксид — зеленого.
Попрацюйте в парах. Проаналізуйте фото з зображенням Хотинської фортеці та її околиць(Чернівецька область, Україна). Випишіть окремо формули несолетворних, оснбвних, кислотних та амфотерних оксидів.

Запитання та завдання 1
1. Розгляньте схему класифікації оксидів металічних елементів. Наведіть додаткові приклади різних оксидів.
2. За яким принципом класифікують оксиди?
3. Як розрізнити кислотні та основні оксиди?
4. Як залежать температури плавлення оксидів від їхньої будови? Чому?
5. Наведіть приклади оксидів та розкажіть про їхню поширеність у природі.
У завданнях 6—9 вкажіть одну правильну відповідь.
6. Вкажіть формулу кислотного оксиду.
A CO2 Б K2O В AI2O3 Г CO
7. Вкажіть назву оксиду CI2O,.
A Xnop(VII) оксид
Б хлор(У) оксид В хлор(ІІІ) оксид Г хлор(І) оксид
8. Вкажіть формулу купрум(ІІ) оксиду.
A CaO Б CuO В Cu2O Г K2O
9. Вкажіть формулу амфотерного оксиду.
A N2O5 Б CO2 В Fe2O3 Г BaO
У завданнях 10—12 встановіть відповідність між:
10. назвою оксиду та його формулою:
А нітроген(І) оксид 1 NO2
Б купрум(ІІ) оксид 2 N2O
В HirporeH(IV) оксид 3 Cu2O
Г купрум(І) оксид 4 CuO
11. характером оксиду та його формулою:
1 основний A CaO
2 кислотний Б AI2O3
3 амфотерний В CO2
Г Na2O
12. характером оксиду та його наоаою:
1 кислотний А алюміній оксид
2 амфотерний Б сульфур(УІ) оксид
3 основний В карбон(ІІ) оксид
Г барій оксид
13. Деякі металічні елементи утворюють оксиди складу: MeO3, MeO1 Me2O3. Який характер — основний, кислотний чи амфотерний — може мати кожен оксид? Відповідь обґрунтуйте.
14. З поданого переліку випишіть формули кислотних оксидів і вкажіть їхні назви: SO3, Ca(OH)2, FeO1 H2O1 H2CO31 KOH1 P2O61 CO21 FeCI31 P2O31 H2SO4.
15. Із наведеного переліку формул випишіть окремо формули оксидів металічних і неметалічних елементів, вкажіть їхні назви:
Ba(NO3)2l CuO1 Zn(NO3)2l K2O1 H2O1 Br2O5l Na2O1CrO3H2CO3l B2O31 HNO31CI2O1 Mn2O7l Zn(OH)2l AI(OH)31 SiO21 PbO1 SO3.
16. Складіть формулу хром(ІІІ) оксиду, що є складовою зеленої фарби, та обчисліть масові частки елементів.
17. У процесі фотосинтезу зелені рослини поглинають вуглекислий газ і виділяють необхідний для людини й більшості живих істот кисень. Обчисліть число молекул карбон(ІУ) оксиду, що поглинають тополя та липа, якщо за літо тополя поглинає 44 кг вуглекислого газу, липа — 16 кг.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 22:03, Переглядів: 2143