Будова атома. Сучасне формулювання періодичного закону
Періодичному законові майбутнє не загрожує руйнуванням, а лише надбудови і розвиток обіцяє.
Д.І. Менделєєв
Після опрацювання параграфа ви зможете:
• розрізняти атомне ядро, електрони, протони, нейтрони;
• характеризувати склад атомних ядер (кількість протонів і нейтронів у нукліді);
• сформулювати сучасне означення періодичного закону.
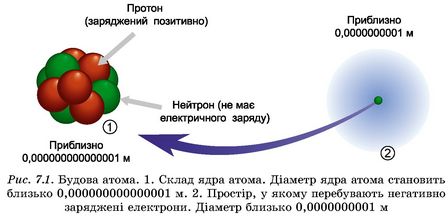
Будова атома. З курсу хімії 7 класу ви, звісно, пам’ятаєте, що атом складається з позитивно зарядженого ядра, навколо якого перебувають негативно заряджені електрони, які утворюють електронну оболонку (рис. 7.1).
Протон-нейтронну модель ядра в 1932 р. запропонував уродженець Полтавщини Дмитро Дмитрович Іваненко (рис. 7.2). На сьогодні ця ідея видається дуже простою, однак тоді, коли тільки-но було відкрито нейтрон, цю проблему не міг розв’язати жоден інший фізик.
 |
Рис. 7.2. Іваненко Дмитро Дмитрович (1904-1994). Видатний фізик-теоретик XX століття. Запропонував протон-ней-тронну модель атомного ядра. Один з авторів першої моделі ядерних сил |
Ернест Резерфорд (рис. 7.3), наприклад, висунув помилкову гіпотезу, що атомні ядра складаються з протонів і електронів. Він, як і чимало інших науковців того часу, був переконаний, що може існувати електро-нейтральне атомне ядро, яке складається з одного протона й одного електрона.
 |
Рис. 7.3. Резерфорд Ернест (1871-1937). Англійський фізик, один із творців учення про радіоактивність і будову атома, засновник наукової школи. Відкрив (1899) альфа-і бета-промені та встановив їхню природу. Створив (1903, разом з Ф. Содді) теорію радіоактивності. Запропонував (1911) планетарну модель атома. Здійснив (1919) першу штучну ядерну реакцію. Спрогнозував (1921) існування нейтрона. Лауреат Нобелівської премії (1908) |
Чимало науковців уважали саме таким нейтральним ядром нейтрон, відкритий у 1932 р. Джеймсом Чедвіком (рис. 7.4). Однак з’явилися експериментальні дані, які змусили сумніватись у гіпотезі Резерфорда.
 |
Рис. 7.4. Чедвік Джеймс (1891-1974). Англійський фізик, учень Е. Резерфорда. Закінчив Манчестерський і Кембриджський університети, з 1923 р. працював у Кавендишській лабораторії. Проводив дослідження з ядерної фізики, лауреат Нобелівської премії з фізики 1935 р. за відкриття нейтрона. У 1943-1945 роках керував групою англійських науковців, які працювали над створенням атомної бомби в США |
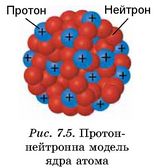
Після відкриття нейтрона Дмитро Дмитрович Іваненко висунув гіпотезу: до складу атомних ядер входять важкі частинки - протони і нейтрони (рис. 7.5).
Разом з тим гіпотеза Дмитра Іваненка полягала не просто в тому, що ядра складаються з протонів і нейтронів, а, насамперед, в уявленні про нейтрон як елементарну частинку: «Нейтрон так само елементарний, як протон», - зазначав Іваненко.
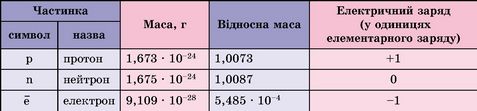
Протони, нейтрони, електрони - субатомні частинки. Використовуючи дані таблиці 7.1, доведіть, що в ядрі зосереджена чи не вся маса атома.
Таблиця 7.1
Субатомні частинки
Отже, ядро атома містить частинки двох типів: протони і нейтрони. В ядрі зосереджена практично вся маса атома. Загальну кількість протонів і нейтронів у атомі називають нуклонним числом. Це число є відносною масою ядра атома. Кількість протонів в атомі хімічного елемента називають протонним числом. Кількість протонів у ядрі атома дорівнює порядковому номеру елемента:
N(p+) = Z,
де Z - порядковий номер елемента в періодичній системі (пригадайте, про це вже йшлося на с. 5).
Наприклад, порядковий номер Натрію в періодичній системі хімічних елементів - 11. Це означає, що в ядрі його атома 11 протонів, а навколо ядра - 11 електронів.
Число нейтронів у ядрі дорівнює різниці між нуклонним і протонним числами.
N(n0) = A - N(p+),
де N(n°) = A - Z; А - нуклонне число, N(p+) - протонне число, N(n°) - число нейтронів. Приміром, нуклонне число Алюмінію становить 27. Його протонне число - 13. Щоб визначити кількість нейтронів в ядрі атома цього хімічного елемента, потрібно обчислити різницю між нуклонним і протонним числами. Вона дорівнює 14.
Ізотопи - різновиди атомів одного хімічного елемента з різною кількістю нейтронів. Різновид атомів з певною кількістю нейтронів у ядрі називають нуклідом.
Ізотопи — це нукліди одного хімічного елемента.
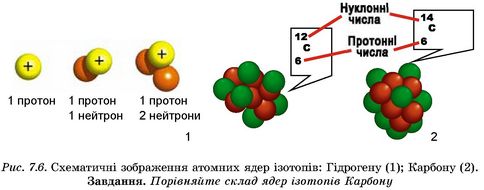
Радіоактивний нуклід скорочено називають радіонуклідом. Термін «ізотопи» застосовують для позначення стабільних і радіоактивних нуклідів одного елемента. Наприклад, Протій, Дейтерій, Тритій - ізотопи Гідрогену. Чим вони подібні і чим відрізняються, легко зрозуміти, розглянувши рисунок 7.6.1.
Кожний нуклід позначають символом відповідного хімічного елемента. Склад нукліда характеризують дві величини: нуклонне число - лівий надрядковий індекс біля хімічного знака і протонне число - лівий підрядковий індекс біля хімічного знака (рис. 7.6.2).
Атомна маса елемента дорівнює середньому значенню мас усіх його природних ізотопів з урахуванням їхньої поширеності. Це одна з причин того, що значення відносних атомних мас у періодичній системі не є цілими числами. Наприклад, у природному Хлорі атомна частка нукліда Хлору-35 35C1 становить 75,4 %, а Хлору-37 37C1 - 24,6 %. Тож середня відносна атомна маса Хлору дорівнює 35,453:
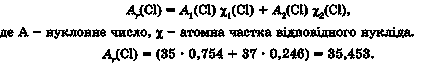
 |
Рис. 7.7. Мозлі Генрі Гвін Джефріс (1887-1915). Англійський фізик. Закінчив Оксфордський університет (1910). У 1910-1914 рр. працював у Манчестерському, а потім -Оксфордському університетах. У лабораторії Е. Резерфорда (Манчестер) проводив дослідження з P- і у-спектроскопії й спектроскопії рентгенівських променів. Установив (1913) зв’язок між частотою характеристичних ліній рентгенівських променів і атомним номером елемента. Загинув під час Першої світової війни |
Завдяки дослідженню рентгенівських спектрів Г. Мозлі зумів визначити заряди ядер атомів хімічних елементів. Виявилось, що вони дорівнюють їхнім порядковим номерам у періодичній системі. Окрім того, він передбачив існування ще не відкритих на той час елементів із номерами 43, 61, 72, 75.
У результаті титанічної праці Генрі Мозлі довів, що розташування елементів у періодичній системі строго закономірне, порядковий номер кожного елемента - це цілком визначена його характеристика (заряд ядра). Те, що здавалося прикрим винятком (ідеться про порушення послідовності розміщення в таблиці деяких елементів за зростанням атомної маси), завдяки роботам Мозлі було пояснено.
Отже, і величина заряду ядра атома, і кількість електронів навколо ядра дорівнюють порядковому номеру елемента в періодичній системі.
Тож сучасне формулювання періодичного закону таке:
Властивості хімічних елементів та їхніх сполук перебувають у періодичній залежності від значень зарядів ядер атомів.
ПРО ГОЛОВНЕ
• Атом складається з позитивно зарядженого ядра, навколо якого перебувають негативно заряджені електрони, які утворюють електронну оболонку.
• Ядро атома містить частинки двох типів: протони і нейтрони.
• Загальну кількість протонів і нейтронів у атомі називають нуклонним числом. Це число є відносною масою ядра атома.
• Кількість протонів в атомі хімічного елемента називають протонним числом. Кількість протонів у ядрі атома дорівнює порядковому номеру елемента в періодичній системі.
• Кількість нейтронів у ядрі дорівнює різниці між нуклонним і протонним числами.
• Різновид атомів з певною кількістю нейтронів називають нуклідом.
• Ізотопи - це нукліди одного хімічного елемента.
• Властивості хімічних елементів та їхніх сполук перебувають у періодичній залежності від значень зарядів ядер атомів.
Перевірте себе
1. Який склад атома? 2. З яких частинок складається атомне ядро? 3. Що таке протонне число? Нуклонне? 4. Як за положенням хімічного елемента в періодичній системі визначити число протонів у ядрі його атома? 5. Що таке нуклід? Ізотопи? 6. Як визначити число нейтронів у ядрі нукліда?
Застосуйте свої знання й уміння
1. Які з наведених тверджень правильні?
1) уся маса атома зосереджена в його ядрі;
2) атом - заряджена частинка;
3) атом є суцільним;
4) атом складається з ядра й електронів;
5) ядро атома заряджене позитивно;
6) ядро атома трохи менше за атом.
2. Поясніть фізичний зміст протонного і нуклонного чисел.
3. Визначте кількість протонів в атомі Купруму.
4. Порівняйте склад ізотопів: а) 35CI і 37CI; б) 64Zn, 60Zn, 67Zn, 68Zn і |°Zn; в) ^С і 16С.
5. Скільки нейтронів у нукліді 60Zn?
А 30 Б 68 В 98 Г 38
6. Яка сумарна кількість нейтронів і електронів у нукліді 2і^с?
1) 21; 2) 45; 3) 66; 4) 24; 5) 33.
7. Відносна молекулярна маса леткої сполуки галогену з Гідрогеном - 20. Визначте кількість протонів у ядрі атома цього галогену.
8. Відносна маса структурної одиниці гідроксиду лужного елемента - 56. Визначте величину заряду ядра атома цього елемента.
Творча майстерня
Підготуйте для однокласників презентацію «Як було встановлено будову атома».
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 02:57, Переглядів: 2028