§ 8. Ізотопи
Опрацювавши параграф, ви дізнаєтеся, що таке:
протонне і нуклонне число;
ізотопи;
нуклід.
1. Протонне число
У 1913 році учень Е. Резерфорда англійський фізик Г. Мозлі у дослідах з рентгенівськими променями визначив заряди атомних ядер багатьох хімічних елементів і довів, що заряд ядра атома завжди чисельно дорівнює порядковому (атомному) номеру елемента в періодичній системі:
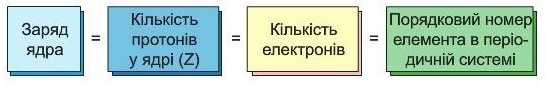
Кількість протонів у ядрі атома називають протонним числом
(Z).
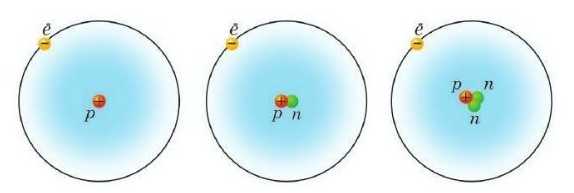
Мал. 3. Три ізотопи Гідрогену
θ Знайдіть у періодичній системі Кальцій і Сульфур, запишіть у зошиті їхні протонні числа.
2. Нуклонне число
Оскільки порядковий номер Гідрогену дорівнює 1, то ядра усіх атомів Гідрогену мають заряд +1, тобто містять 1 протон (Ζ = 1). У той же час атоми Гідрогену можуть відрізнятися за числом нейтронів у ядрі (а, отже, за масою): ядра атомів звичайного Гідрогену зовсім не містять нейтронів (N = 0), ядра тяжкого Гідрогену (Дейтерію) містять один нейтрон (АГ = 1), а ядра надтяжкого Гідрогену (Тритію) — 2 нейтрони (АГ = 2) (мал. 3). Тому для характеристики атома використовують ще одну величину — нуклонне число А, яке дорівнює сумі протонів та нейтронів у ядрі атома:

Оскільки маса кожного протона і нейтрона приблизно дорівнює 1 а. о. м., а маса електрона дуже мала, то нуклонне число атома приблизно дорівнює числовом}' значенню його відносної атомної маси.
У ядерній хімії використовують спеціальні позначення атомів: протонне число записують зліва внизу від символу хімічного елемента, а нуклонне число — зліва зверху, наприклад:
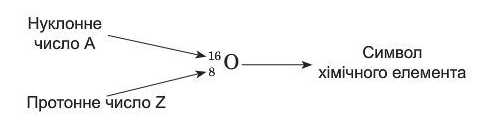
Інколи нижній індекс не записують: 1βΟ.
Знайдіть у періодичній системі Фосфор і Алюміній, запишіть у зошиті їхні символи з позначенням нуклонного і протонного числа.
3. Ізотопи
Різновидності атомів одного і того ж хімічного елемента, які мають різну кількість нейтронів у ядрі, називають ізотопами.
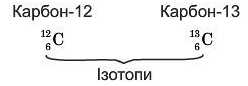
У назвах ізотопів, крім назви хімічного елемента, вказують і нуклонне число:
Усього відомо близько 2000 ізотопів, з яких близько 300 існують у природі, а решта отримані штучно. Наприклад, у природі зустрічаються три ізотопи Оксигену: Оксиген-16 (jfiO), Оксиген-17 (17O) і Оксиген-18 (18O). Хімічні властивості ізотопів однакові, а деякі фізичні властивості дещо відрізняються.
Знаючи порядковий номер елемента і нуклонне число ізотопу, легко розрахувати, скільки електронів, протонів та нейтронів містить даний атом.
Число електронів дорівнює числу протонів (протонному числу), а число нейтронів дорівнює різниці між нуклонним і протонним числом:
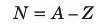
ЗАДАЧА. Скільки електронів, протонів та нейтронів міститься в ядрі Урану-238?
Розе ’язання
Уран має порядковий номер 92. Отже, атом Урану містить 92 протони і 92 електрони. Знайдемо число нейтронів у ядрі атома:
N = A-Z = 238-92 = 146.
Відповідь: 92 електрони, 92 протони, 146 нейтронів.
Усі хімічні елементи мають по кілька ізотопів, причому чим вищий заряд ядра атома елемента, тим більше ізотопів він має. Так, Гідроген утворює всього три ізотопи, а Плюмбум (Z = 82) — 32 з нуклонними числами від 183 до 214. З них лише 4 знайдені в природі, а решта отримані штучно.
Багато хімічних елементів зустрічаються в природі у вигляді суміші декількох ізотопів, наприклад Карбон (12C, 13C і 14C), Нітроген (14N і 15N) тощо. Рекордсменом за числом природних ізотопів (10) є Станум. У той же час деякі хімічні елементи мають лише один природний ізотоп, наприклад Флуор (19F), Натрій (23Na), Алюміній (27Al), Фосфор (31P).
Ви, напевно, помітили, що значення відносних атомних мас елементів, наведені в періодичній системі, не є цілочисельними: Ar(C) = 12,011, Ar(Cl) = 35,453. Насамперед це пов’язано з тим, що більшість елементів трапляються у природі у вигляді декількох ізотопів, і наведене в таблиці значення є середнім, яке розраховане на основі атомної частки кожного з ізотопів у земній корі. Так, природний Хлор приблизно на 75% складається з атомів 35Cl і на 25% із 37Cl, тому його середня відносна атомна маса дорівнює 35,5: Ar(Cl) = 0,75 · 35 + 0,25 · 37 = 35,5.
4. Нуклід
І Нуклід — це будь-який вид атомів з певним протонним і нукпонним числом.
Нуклідами є атоми будь-якого елемента, наприклад: 31P, 23Na, 63Cu та інші.
Тому можна інакше сформулювати поняття «ізотопи».
Ізотопи — це нукліди певного хімічного елемента.
O ...більшість видів атомів є стійкими, тобто їхні ядра залишаються незмінними довгий ішс. Проте деякі ізотопи мають здатність спонтанно перетворюватись на атоми інших елементів, випромінюючи електрони або ядра Гелію. Здатність ядер атомів спонтанно розпадатися називають радіоактивністю. А елементи, усі ізотопи яких нестійкі і спонтанно розпадаються, називають радіоактивними. Радіоактивними є усі елементи після Вісмуту у періодичній системі. Для багатьох із них наведена не середня відносна атомна маса, а нуклонне число ізотопу з найдовшою тривалістю «життя» (воно записане в квадратних дужках).

...явище радіоактивності досліджували А.А. Беккере.аь, Г. Шмідт, П'єр Кюрі і Марія Склодовська-Кюрі.
— ВИСНОВКИ і·
Кількість електронів і протонів в атомі однакова і дорівнює порядковому номеру елемента в періодичній системі.
Протонне число — це кількість протонів у ядрі атома.
Нуклонне число — сума протонів і нейтронів у ядрі атома.
Ізотопи — це різновиди атомів одного і того ж хімічного елемента з різною кількістю нейтронів у ядрі.
Нуклід — це будь-який вид атомів з певним нуклонним числом.
Початковий рівень
1. Укажіть протонні числа Карбону, Хлору, Силіцію, Купруму.
2. Чим відрізняються між собою ізотопи?
Середній рівень
3. Напишіть символи хімічних елементів, ядра атомів яких містять: а) 2 протони і 2 нейтрони; б) 15 протонів і 16 нейтронів; в) 35 протонів і 45 нейтронів.
4. Ядро атома хімічного елемента містить 2 протони і 1 нейтрон. Запишіть позначення цього атома, вказавши хімічний символ, протонне і нуклонне число.
5. Протон є ядром деякого атома. Запишіть позначення цього атома.
Достатній рівень
6. Із наведеного переліку виберіть а) ізотопи; б) атоми з однаковим числом нейтронів у ядрі; в) атоми з однаковими нуклон-ними числами: J6O, “С , 1JN, 1JC.
7. Скільки протонів і нейтронів містять ядра Оксигену-17, Карбону- 14, Цезію-137?
8. Скільки протонів та електронів міститься в: а) атомі Оксиге-ну; 6) молекулі води?
Високий рівень
9. Який нуклід Натрію містить таке ж число нейтронів, що й нуклід 24Mg?
10. Скільки різних видів молекул води може бути утворено із трьох ізотопів Гідрогену' і трьох ізотопів Оксигену?
11. Скільки електронів у молекулі карбон(П) оксиду'? Назвіть просту речовин}', молекула якої містить стільки ж електронів.
12. * У природі Купрум зустрічається у вигляді двох ізотопів: 63Cu і
fi5Cu. Розрахуйте атомну' (мольну') частку' кожного з них у земній корі, якщо відносна атомна маса Купруму дорівнює 63,5.
13. * Укажіть сумарну' кількість електронів, протонів і нейтронів
уйоні J75Cl-.
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 21:58, Переглядів: 4055