§ 9. Склад атомних ядер. Ізотопи
Опрацювавши зміст параграфа, ви будете:
• мати уявлення про стабільні й радіоактивні ізотопи; період піврозпаду; радіаційну безпеку;
• розуміти зміст понять «протон», «протонне число», «нейтрон»; «нуклонне число»; «нуклід», «ізотопи»;
• уміти визначати число нейтронів у ядрі певного нукліда; користуватися зазначеними поняттями.
Ви вже знаєте, що атом складається з ядра й електронів. У свою чергу, ядро атома, згідно із сучасними уявленнями, складається з протонів і нейтронів, загальна назва яких нуклони (від лат. nucleus - ядро).
Що собою являють ці субатомні частинки? Аби відповісти на це запитання розгляньте табл. 4.
Таблиця 4
Характеристика субатомних частинок
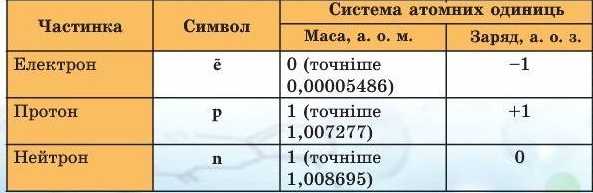
Виявляється, протон (символ р) має заряд +1, а нейтрон (символ п) заряду не має. Число протонів у ядрі атома дорівнює порядковому номеру елемента і визначає його місце у Періодичній системі, тому порядковий номер елемента називають протонним числом. Отже,
протонне число (порядковий номер) дорівнює величині заряду ядра атома елемента.
Маса протона майже така сама, як і маса нейтрона, і становить одну атомну одиницю маси (а. о. м.), що в 1836 разів більше за масу електрона. Це означає, що практично вся маса атома зосереджена в його ядрі.
Маса атома та його розміри надзвичайно малі. Ще менше ядро атома. Воно у 10-100 тисяч разів менше за атом. Якби атом можна було збільшити до розмірів Землі, то його ядро мало б радіус лише 30-60 м.
Як же утримуються протони й нейтрони в ядрі? Адже всі протони позитивно заряджені, а нейтрони - електронейтральні. Чому ж ядро не розсипається на окремі частинки? Протони і нейтрони утримуються в ядрі специфічними ядерними силами. Ці сили діють лише на дуже малих відстанях (не більше IOj3Cm) і досягають надзвичайної величини, яка в 100-1000 разів перевищує кулонівське відштовхування однойменно заряджених протонів. Природа ядерних сил остаточно ще не з'ясована.
А як можна визначити склад атомних ядер? Ви знаєте, що протонне число елемента відповідає величині заряду ядра його атома, тобто числу протонів. І знаєте відносну атомну масу елемента, яка дорівнює переважно сумі протонів і нейтронів, тому легко можете обчислити число нейтронів у ядрі. Наприклад, протонне число елемента Калію дорівнює 19. Це означає, що заряд ядра його атома +19, тобто в ядрі міститься 19 протонів. Оскільки відносна атомна маса Калію дорівнює 39, то в ядрі його атома міститься: 39 - 19 = 20 нейтронів.
Кожний вид атомів, незалежно від того, якому елементу він належить, однозначно описується сумою протонів і нейтронів - нуклонним числом. Саме тому видів атомів більше, ніж елементів. Кожен окремий вид атомів (вид ядер) називається нуклідом.
Нукліди - різновиди атомів (атомних ядер) з певним числом протонів і нейтронів.
Термін «нуклід» вживається для позначення будь-яких атомів, що відрізняються складом ядра (або різним числом нуклонів, або, при однаковому числі нуклонів, різним співвідношенням протонів і нейтронів).
Для позначення нукліда використовують або назву елемента, до якої через дефіс приєднують нуклонне число (Оксиген-16), або символ елемента, згори ліворуч від якого також зазначають нуклонне число (16O).
Якщо нукліди належать одному й тому самому хімічному елементу і мають однакову кількість протонів, але різняться за кількістю нейтронів, то вони називаються ізотопними нуклідами, або просто ізотопами.
Ізотопи - нукліди одного хімічного елемента, які мають однакове протонне число (заряд ядра).
Зверніть увагу, термін «ізотопи» вживається лише у множині (застаріле «ізотоп» і є нуклід).
Наприклад, природний Оксиген, крім нуклідів 16O, містить ще атоми з нуклонними числами 17 і 18. Це означає, що в природному Оксигені є різні види атомів, які в ядрі містять однакову кількість протонів (по 8), але різну кількість нейтронів (відповідно 8, 9,10). Саме тому вони й різняться між собою атомною масою. Зазначені нукліди 160,170,18O і є ізотопами Оксигену.
Назви і символи ізотопів збігаються з назвами та символами відповідного хімічного елемента. Виняток становлять лише ізотопи найлегшого з елементів - Гідрогену. Вони мають нуклонні числа 1, 2, 3 і власні назви та символи (табл. 5).
Таблиця 5
Ізотопи Гідрогену і Карбону
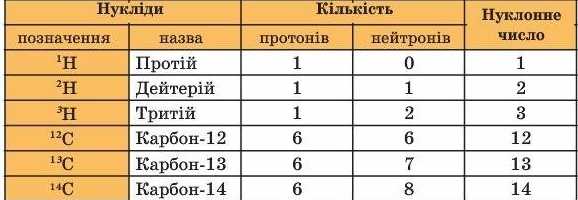
Відкриття ізотопів дало змогу поглибити знання про хімічний елемент як вид атомів, що характеризується однаковим протонним числом (зарядом ядра).
Зазвичай у природі більшість хімічних елементів існує у вигляді ізотопів, тому відносна атомна маса таких елементів визначається величиналш відносних атомних мас кожного з нуклідів з урахуванням їх масової частки
в природі. Наприклад, елемент Оксиген являє собою суміш ізотопів - нуклідів 16O 99,757 %, 17O 0,039 %, 18O 0,204 %. Аби дізнатись про відносну атомну масу Оксигену, треба:
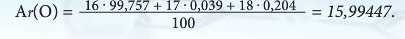
Заокруглюємо знайдене середнє значення, виходить Ar(O) = 16.
Саме тому, що майже всі елементи - це суміші нуклідів, їхні відносні атомні маси не цілочислові, а дробові.
Але ви можете заперечити: чому ж тоді відносна атомна маса таких елементів, як Натрій, Алюміній, Фосфор, Флуор, які не мають ізотопів, не є цілочисловою, а лише наближається до неї? Це пояснюється тим, що Карбон, який береться за точку відліку атомних мас інших елементів, сам складається з двох природних ізотопів 12C і 13C, а для визначення відносної атомної маси береться один із природних ізотопів, саме 12C, або Карбон-12.
Оскільки ізотопи певного елемента мають однакове протонне число (заряд ядра), то їхні хімічні властивості також практично однакові. Тому можна говорити про хімічні властивості, наприклад Хлору, не беручи до уваги його ізотопний склад.
Ізотопи (окремі нукліди) поділяють на стабільні й радіоактивні (радіонукліди). Усі «парні» елементи мають стабільні нукліди, а також більшість «непарних» з протонним числом < 83. Нукліди всіх елементів, розміщених)' Періодичній системі після Вісмуту Bi, радіоактивні.
Інтервал часу, протягом якого кількість радіоактивних атомів певного елемента зменшується вдвічі, називається періодом піврозпаду
Висновки
Ядра атомів мають складну будову. Вони складаються з двох видів частинок - протонів і нейтронів, що утримуються ядерними силами.
Протон р - позитивно заряджена частинка із зарядом +1 і масою, яка практично дорівнює 1, тому ядра атомів заряджені позитивно. Величина їхнього заряду чисельно дорівнює кількості протонів - протонному числу.
Нейтрон η - електронейтральна частинка, маса якої практично також дорівнює 1.
Масу атома обумовлює загальне число протонів і нейтронів - нуклонне число.
Кількість нейтронів у ядрі атома чисельно дорівнює різниці між масою атома і масою протонів.
Загальна назва атомів (атомних ядер) з певним значенням нуклонного числа - нукліди.
Ізотопи - нукліди одного хімічного елемента. Вони мають однакове число протонів, але різне число нейтронів. У Періодичній системі ізотопи займають одне й те саме місце.
Нукліди бувають стабільні та радіоактивні. Останні самочинно розпадаються, що супроводжується випромінюванням - радіацією, яка шкідливо впливає на все живе.
,Завдання для самоконтролю
1. Протонне число елемента дорівнює загальному числу:
А нейтронів; В нейтронів і протонів;
Б протонів; Г протонів і електронів.
2. Як ви думаєте, чому протонне число є важливою константою хімічного елемента? Відповідь обґрунтуйте.
3. Основний внесок у масу атома роблять:
А протони й електрони; В протони і нейтрони;
Б ядро; Г нейтрони і електрони.
4. Загальне число електронів у атомі елемента з протонним числом 13 і відносною атомною масою 27:
А 13; Б 14; В 27; Г 40.
5. Число протонів у нукліді Фосфору:
А 15; Б 17; В 31; H 40.
6. Число нейтронів у нукліди Урану:
А 235; Б 92; В 327; Г 146.
7. Ядро атома одного з ізотопів Купруму містить 36 нейтронів. Нуклонне число цього нукліда дорівнює:
А 96; Б 29; В 65; Г 94.
Додаткові завдання
8. Що таке хімічний елемент? Як пояснити існування дробових значень відносних атомних мас елементів у Періодичній системі?
9. У молекулі нітроген(ІІ) оксиду загальне число всіх протонів дорівнює:
А ЗО; Б 15; В 14; Г 16.
10*. Атомне співвідношення ізотопів Літію з нуклонними числами 6 і 7 у природному елементі Li дорівнює, відповідно, 7,3 і 92,7 % (атомних відсотків). Середня відносна атомна маса елемента Літію дорівнює:
А 6,52; Б 6,73; В 6,82; Г 6,93.
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:12, Переглядів: 5293