§ 29. Амфотерні гідроксиди й оксиди
Опрацювавши зміст параграфа, ви будете:
• розуміти зміст поняття «амфотерність»;
• знати типові амфотерні гідроксиди й оксиди;
• уміти складати рівняння реакцій, що доводять амфотерність Zn(OH)2 і ZnO.
Ви вже знаєте, що металічні й неметалічні елементи утворюють оксиди, яким відповідають певні основи або кислоти, наприклад:
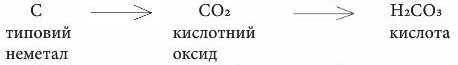

Неметалічні елементи, оксиди й гідрати оксидів яких виявляють тільки кислотні властивості, називають типовими неметалічними елементами (S, Ν, Р, Cl та ін.).
Металічні елементи, оксиди і гідроксиди яких виявляють тільки основні властивості, називають типовими металічними елементами (Na, К, Ca, Ba, Mg тощо).
Є й такі елементи, оксиди й гідроксиди яких здатні виявляти подвійні властивості - як кислотні, так і основні (див. § 23).
Здатність речовин виявляти основні або кислотні властивості залежно від природи сполуки, з якою вони взаємодіють, називається амфотерністю.
Аби переконатися в цьому виконайте лабораторні досліди.
Дослід 1. У пробірку з розчином цинк хлориду ZnCl2 додавайте краплями розчин лугу NaOH. Після додавання кожної краплі злегка струшуйте пробірку. Незабаром вона заповниться білим осадом цинк гідроксиду Zn(OH)2 у вигляді драглистої маси:
ZnCl2 + 2NaOH = Zn(OH)2 ψ+ 2NaCl.
Дослід 2. Вміст пробірки разом з утвореним осадом розділіть на дві порції, переливши частину в іншу пробірку. До однієї порції додайте трохи розбавленої хлоридної кислоти, а до другої - розчину лугу. Що спостерігаєте? Чому осад зник, розчинився? Що це засвідчує? Напишіть рівняння відповідних реакцій.
Як було помітно, осад цинк гідроксиду розчинився в обох пробірках. Отже, цинк гідроксид прореагував і з кислотою, і з лугом. Якщо Zn(OH)2 реагує з кислотою, то він поводить себе як основа, утворюючи сіль і воду:
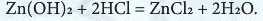
Якщо ж цинк гідроксид Zn(OH)2 реагує з лугом, то він поводить себе як кислота H2ZnO2. Так, під час сплавляння з типовим лугом цинк гідроксид виявляє кислотні властивості, утворюючи також сіль і воду:
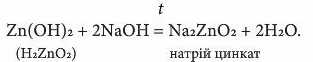
У розчинах процес пов’язаний не тільки із заміщенням атомів Гідрогену в Zn(OH)2 на йони металічного елемента, а й переважно з приєднанням гідроксид-іонів до молекул гідроксиду. Тому утворюються гідроксоцинкати (гідроксосолі слабких кислот):
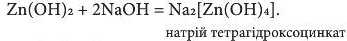
Отже, цинк гідроксид Zn(OH)2 легко взаємодіє і з кислотами, і з лугами, тобто він - амфотерна сполука.
Такі ж подвійні властивості виявляє й цинк оксид:
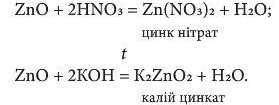
У реакції з кислотою цинк оксид виявляє властивості основного оксиду, а в реакції з лугом - кислотного оксиду. Отже, ZnO - амфотерний оксид. Багато хімічних елементів утворюють амфотерні оксиди (див. § 23).
Для Алюмінію, на відміну від інших елементів, характерно, що не тільки його оксид АЬОз і гідроксид АІ(ОН)з - амфотерні сполуки, а й сам Алюміній може виявляти подвійні властивості. Він реагує з виділенням водню як з кислотами, так і з лугами (у водному розчині та в розплаві):
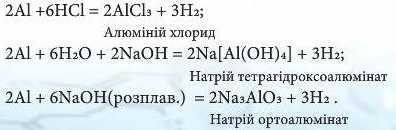
Висновки
Під амфотерністю розуміють здатність хімічної сполуки виявляти кислотні або основні властивості залежно від природи іншої сполуки, яка бере участь у кислотно-основній взаємодії.
Амфотерна речовина, реагуючи з сильною кислотою, виявляє основні властивості, а реагуючи з сильною основою (лугом) - кислотні.
Типовими амфотерними гідроксидами є Ζη(ΟΗ)2, Вє(ОН)2, АІ(ОН)з, Сг(ОН)з тощо.
_ * Завдання для самоконтролю
1. У чом}' полягає суть амфотерності?
2. Як здійснити перетворення:
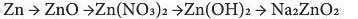
Напишіть відповідні рівняння реакцій і зазначте назви продуктів реакції.
3. Для добування цинк гідроксиду можна використати реакцію, що відбувається за схемою:
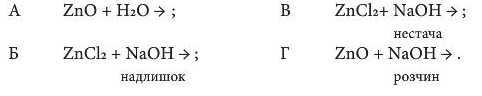
Додаткові завдання
4*. На сплавляння берилій гідроксиду з лугом витрачено калій гідроксид масою 25 г. Кількість речовини калій берилату, що утворився при цьому, становить:
А 1 моль; Б 5 моль; В 0,25 моль; Г 0,125 моль.
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:25, Переглядів: 1724