§ 25. Амфотерні гідроксиди. Їхні фізичні й хімічні властивості
— Що означає слово «амфотерні»?
— Подивімося у словнику: амфі (грецьк. όμφί-) — означає «по обидва боки, навколо», «подвійний, двоякий, двоїстий». І
Іноді для утворення терміна використовують префікс не амфі-, а амфо- (грецьк. άμφω — обидва).
Амфібія — істота (а пізніше й технічний пристрій) І «подвійного життя», тобто така, що існує й на суші ^ й у воді, земноводне.
Амфітеатр (іст.) — місця для глядачів, розташовані навколо арени (у сучасних залах для глядачів — за партером). Амфотерний: амфотерні речовини — ті, що мають двоїсту природу (можуть проявляти або кислотні, або основні
властивості).
СКЛАД І НАЗВИ АМФОТЕРНИХ ГІДРОКСИДІВ
Ми також говорили, що амфотерні оксиди й гідроксиди утворюють метали зі ступенем окиснення +3 (рідше +2 і +4). Приклади амфотерних гідроксидів:
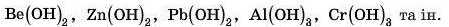
Відповідні їм оксиди також амфотерні (див. § 19).
Згадаємо, що метали, які утворюють амфотерні оксиди й гідроксиди, розташовані в Періодичній системі між типовими металічними й неметалічними елементами. Таким чином, властивості елементів у періодах змінюються не стрибком, а поступово.
ФІЗИЧНІ ВЛАСТИВОСТІ
Амфотерні гідроксиди нерозчинні у воді. Фізичні властивості в них такі самі, яків нерозчинних основ.
ХІМІЧНІ ВЛАСТИВОСТІ
Амфотерні сполуки мають особливість: вони проявляють властивості як кислот, так і основ залежно від того, з якою речовиною вони реагують.
Так, реагуючи із сильною кислотою, вони проявляють основні властивості, а під час реакції із сильною основою — кислотні.
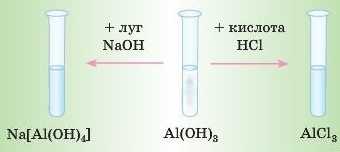
Розберемо ці положення на конкретному прикладі. Алюміній гідроксид — амфотерна речовина. Щоби довести його амфотерність, слід провести реакції і з кислотою, і з основою.
Дослід
Якщо до осаду Al(OH)3 додати кислоти, то відбудеться реакція й осад розчиниться, але якщо додати концентрований розчин лугу, то осад розчиниться також!
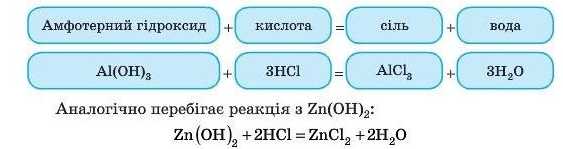
1. Взаємодія з кислотами
Взаємодія Al(OH)3 з кислотою відбувається так само, як і будь-якої іншої основи, у результаті утворюються сіль і вода:
2. Взаємодія з лугами
Взаємодія з лугами може відбуватися по-різному. Реакції в розчинах і розплавах призводять до утворення різних продуктів.
Взаємодія в розплаві
Розглянемо випадок, коли реакція відбувається в розплаві. Оскільки в реакції з лугом Al(OH)ij є кислотою, запишемо його формулу як формулу кислоти:
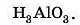
Згадаємо, що нерозчинні основи у процесі нагрівання розкладаються, а оскільки речовини, за умовою, реагують у розплавленому стані, то від сполуки H3AlO3 відщеплюється молекула води:
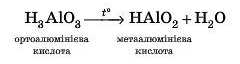
Тоді рівняння виглядає так:
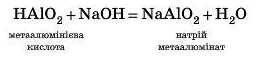
Відбувається реакція обміну між амфотерним гідроксидом — алюмінієвою кислотою — й основою.
Зазвичай цю реакцію записують так:
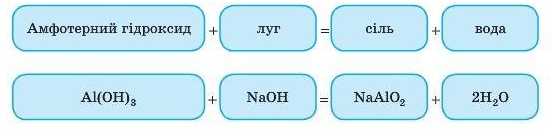
Завдання
Порівняйте ці реакції та реакції взаємодії амфотерних оксидів із лугами (див. § 21).
Під час сплавляння амфотерних гідроксидів із меншим числом гідроксигруп відщеплення молекули води не відбувається:
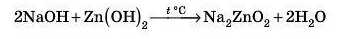
Тут можна представити Zn(OH)2 як H2ZnO2, відповідно, утворюється сіль Na2ZnO2 — натрій цинкат.
Взаємодія в розчині
Якщо реакція відбувається в розчині лугу, то утворюються солі більш складної будови:
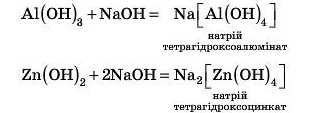
Більш докладно ви будете вивчати такі солі у старших класах.
— Taic що, виявляється, із Ai(OH)3 можна одержати AlCl3, і NaAlO2, і Na[Al(OH).,]?
— Дійсно, це так. В одній солі Al — катіон, в інших — у складі аніона.
— Це дуже складно.
— Так ніхто й не обіцяв, що буде дуже легко й просто.
3. Розклад під час нагрівання
Амфотерні гідроксиди, так само як і інші нерозчинні гідроксиди, розкладаються під час нагрівання:

Отже, ми ознайомилися з хімічними властивостями дивних речовин — амфотерних сполук, які залежно від другого реагенту можуть поводитися і як кислоти, і як основи й утворювати солі різного складу.

ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. У чому особливість хімічних властивостей амфотерних сполук?
2. З якими речовинами слід провести реакції, щоби довес- ” " ти амфотерні властивості гідроксиду або оксиду?
3. Де в Періодичній системі Д. І. Менделєєва розташовані елементи, які утворюють амфотерні сполуки?
4. До амфотерних оксидів належить:
а) CaO;
б) р2о5;
в) Cr2O3;
г) CrO3.
ВИКОНАЙТЕ ЗАВДАННЯ
1. Тільки амфотерні гідроксиди розташовані в ряді:
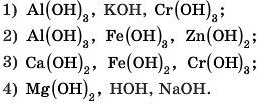
2. Укажіть, з якою речовиною взаємодіють і HNO3, і КОН:
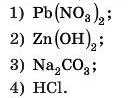
3. Дано речовини: КОН, FeCl3, H2SO4. З якими з них можуть узаємодіяти:
а) натрій гідроксид;
б) кунрум гідроксид;
в) цинк гідроксид?
Напишіть відповідні рівняння реакцій.
4. Наведіть приклади реакцій, що доводять основний характер речовин BaO і Ba(OH)2.
δ. Наведіть приклади реакцій, що доводять кислотний характер оксиду SO3 і його гідроксиду.
6. Наведіть приклади реакцій, що доводять амфотерний характер речовин BeO і Be(OH)2 (реакції відбуваються аналогічно сполукам Цинку).
8. Є наважка алюміній гідроксиду масою 56 г. Обчисліть маси:
7. Установіть відповідність між формулою речовини та її приналежністю до певного класу.
|
Формула речовини а) CsOH б) MnO в) Al2O3 г) K2CO3 Д) SiO2 |
Клас неорганічних сполук 1) Амфотерний оксид 2) Основний оксид 3) Сіль 4) Луг 5) Амфотерний гідроксид 6) Кислотний оксид |
а) хлоридної кислоти,
б) розчину натрій гідроксиду, необхідних для повного розчинення алюміній гідроксиду.
9. Потрібно одержати 40 г цинк оксиду. Яку масу цинк гідроксиду треба розкласти для цього?
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:14, Переглядів: 5731