§ 4. Хімічний елемент. Нукліди. Ізотопи. Відносна атомна маса
— Цікаво, яка частинка атома найголовніша?
— Головних частинок немає, але хімічний елемент ми визначаємо за кількістю протонів.
ЩО ТАКЕ ХІМІЧНИЙ ЕЛЕМЕНТ
Головна характеристика атома — позитивний заряд його ядра, тобто число протонів.
Приклад
Якщо забрати з ядра атома Карбону один протон, одержимо ядро атома... (Бору), а якщо додамо один протон, то одержимо ядро атома... (Нітрогену).
Якщо ми збільшимо або зменшимо число протонів у ядрі, то одержимо ядро іншого елемента, з іншим порядковим номером.
Виявляється, що, змінюючи кількість протонів у ядрі, ми можемо одержати нові хімічні елементи з певним числом протонів, а отже, і зарядом ядра.
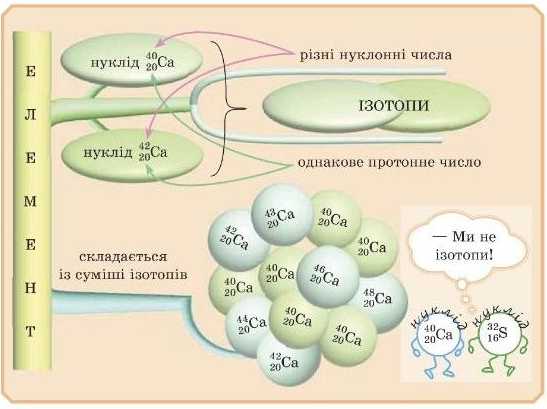
Хімічний елемент — де різновид атомів з однаковим позитивним зарядом ядра (або інакше — з однаковою кількістю протонів у ядрі).
Чи молена практично одержати нові елементи, додаючи або забираючи нротони з ядер? Так, у природі цей процес відбувається весь час. Тому сумарна маса якихось елементів на Землі зменшується, а якихось — збільшується. Реакції, під час яких можливі такі зміни, називають ядерними реакціями. Вчені також проводять такі реакції. Для цього потрібне спеціальне обладнання.
До речі, елементи, які було відкрито останнім часом, одержували штучно шляхом ядерних реакцій. Такі реакції ви будете вивчати в курсі фізики.
НУКЛІДИ
Щоб указати масове число конкретного атома елемента й заряд його ядра, використовують такий запис:
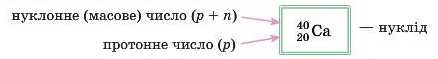
Завдання
Запишіть символами нукліди: Карбон-12, Стронцій-88. Визначте в них число протонів і нейтронів.
Відповідь. 6 С, протонів — 6, нейтронів — 12-6 = 6; gSr, протонів — 38, нейтронів —
88-38 = 50.
Виходить, що такий запис повністю характеризує ядро атома.
Нуклід — це різновид атомів, у яких до складу ядра входить чітко визначене число протонів і нейтронів.
—
Назва нукліда включає його масове число. Наприклад, Кальцій-40:
20Ca, Кальцій-42: JoCa.
Якщо ви правильно записали
символами й цифрами нуклід, то порахувати число нейтронів дуже легко: просто відніміть від верхнього числа (иуклонно-го) нижнє (протонне). Вони вже написані у стовпчик! Для JJjCa Де буде так: 42-20 = 22.
ІЗОТОПИ
Зміна числа нейтронів у атомі не впливає на заряд ядра, тому атоми з різною кількістю нейтронів можуть належати до одного й того самого хімічного елемента. Однак нри цьому атоми матимуть різну масу.
Різновиди атомів одного й того самого елемента (тобто з однаковим числом протонів — зарядом ядра) з різним масовим числом (тобто з різним числом нейтронів) називають ізотопами.
Можна дати й таке визначення:
Ізотопи — атоми одного й того самого елемента, які мають різні нуклонні числа (але заряд ядра атома однаковий).
Майже всі елементи, які поширені на земній кулі, представлені декількома ізотопами. Зазвичай ізотопи мають однакові назви (це ж один і той самий елемент!) із зазначенням масового числа. Наприклад, Хлор-35 або Хлор-37. їх записують символами, із зазна-ченням нуклонного числа й «гасла протонів, наприклад: 17С1, 17С1.
ΑΛ
Може трапитися таке позначення нукліда або ізотопу: ‘ К. Тут немає протонного числа, тільки нуклонне. Але ми завжди можемо визначити протонне число за номером елемента в Періодичній системі та, в разі необхідності, дописати його.

Традиційно ізотони Гідрогену можуть буги записані різними символами. Вони представлені в схемі.
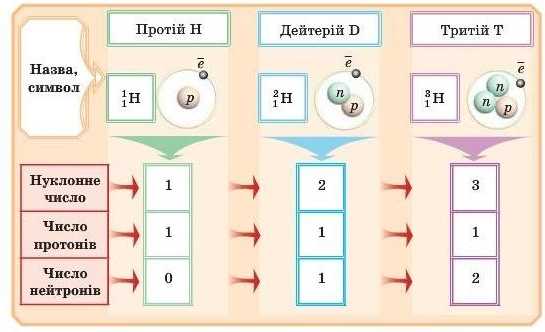
У природі ізотопів одного й того самого елемента різна кількість. Наприклад, Гідроген трапляється у вигляді двох ізотопів — Протію й Дейтерію (Тритій отримано штучно). Визначено, що вміст його ізотопів у природі є таким (у% від загального числа атомів): І H — 99,984% (D) — 0,0156%
Оксиген у природі існує у вигляді трьох ізотопів:
J6O — 99,759% I7O — 0,037% J8O — 0,204%
Під час утворення хімічних речовин — простих і складних — різні ізотопи входять до їхнього складу випадковим чином.
Приклад
Уявіть, що перед вами атоми JH, JH і g60. Які молекули води можуть утворитися із двома різними ізотопами Гідрогену? Формула води — H2O. Значить, у молекулу можуть входити два будь-яких ізотопи атомів Гідрогену. Які з них конкретно будуть входити в молекулу — визначає випадковість. Розглянемо можливі варіанти молекул води, прийнявши, що в цьому випадку Оксиген буде представлений тільки g6 O:
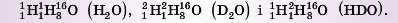
Усього три варіанти. У природі варіантів молекул води більше, тому що вони включають і різні ізотопи Оксигену.

Завдання
Напишіть усі можлиоі варіанти молекул природної води. Природні ізотопи Гідрогену й Оксигену наведено в параграфі.
ВІДНОСНА АТОМНА МАСА
Із курсу 7 класу ви знаєте, що є таке поняття — відносна атомна маса. Це маса одного атома якого-небудь елемента, виражена в атомних одиницях маси (а.о.м).
4А
А.о.м. — це 1/12 маси атома Карбону С.
Як бути з ізотопами під час розрахунку відносної атомної маси? Адже треба врахувати, що в природному стані кожний хімічний елемент містить різні ізотопи. На сьогодні визначено масові частки ізотонів усіх елементів на планеті Земля. Цим займається наука геохімія. Тому внесемо уточнення у визначення.
Відносна атомна маса хімічного елемента (Ar) величина, що дорівнює відношенню середнього значення мас усіх його природних ізотопів, з урахуванням їх поширеності, до 1/12 маси атома Карбону 12C.
Ми пам’ятаємо, що Ar зазначена в Періодичній системі Д. І. Менделєєва. Як правило, це дробова величина. Щоб її обчислити, треба масу кожного ізотопу певного елемента помножити на його вміст на Землі (у%), потім добутки скласти й розділити на 100%.
Приклад
Обчислити середню атомну масу природного літію (Li), якщо вміст у земній корі його ізотопів у відсотках: "Li 7/12 %, Li 92,58%. Розв'язання.
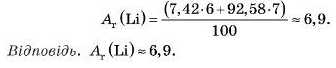
Зробимо висновок:
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. iIhcjio яких частинок є головною характеристикою атома елемента?
2. Що таке хімічний елемент?
3. Дайте визначення нукліду.
4. Що такс ізотопи? Яких частинок у ізотопах однакова кількість? Число яких частинок у ізотопах відрізняється?
5. «В атомах протонне число однакове, а нуклонне число відрізняється» прочитав учень у підручнику хімії. Про що йдеться? Відповідь обґрунтуйте.
6. Як обчислюють відносну атомну масу елемента з урахуванням ізотопного складу?
ВИКОНАЙТЕ ЗАВДАННЯ
1.3 ядра атома Плюмбуму видалили три протони. Ядро атома якого елемента утворилося?
2. Скільки протонів потрібно додати в ядро атома Родію, щоб одержати ядро Технецію?
3. Запишіть символами й цифрами нукліди: Цезій-135, Строн-цій-90, Йод-127, Сульфур-32.
4. Укажіть правильну відповідь у таких завданнях:
• Ізотоп — це:
а) вид атомів різних хімічних елементів, які мають різні ну-клонні числа й заряд ядра атома;
б) вид атомів одного й того самого хімічного елемента, які мають різні нуклошіі числа, але однаковий заряд ядра атома;
в) вид атомів одного й того самого елемента, які мають однакові нуклонні числа, але різні заряди ядер атомів;
г) вид атомів різних елементів, які мають однакові нуклонні числа, але різні заряди ядер атомів.
• Дано числа:
а) 24; б) 28; в) 48; г) 52. ^
✓ Яке із них чисел дорівнює кількості протонів у атомі o2Cr? ν' Яке із цих чисел дорівнює кількості нейтронів у атомі ,2Сг?
✓ Яке із цих чисел дорівнює масовому числу ’ Cr?
• Чим відрізняються за своїм складом ядра ізотопів 39K і 10K?
а) Порядковим номером;
б) кількістю електронів;
в) кількістю протонів;
г) кількістю нейтронів.
Періодичний закон і Періодична система хімічних елементів, будова атома
• Обчисліть відсотковий уміст ізотопів 35Cl і 3'Cl, якщо відносна атомна маса Хлору становить 35,48:
а) 16 і 84%;
б) 76 і 24 %;
в) 24 і 76%;
г) 65 і 35%.
• Кількість протонів, нейтронів і електронів у нукліді ' K дорівнює:
а) 39ру 19п, 39с;
б) 19р, 20п, 19с;
в) 19р, 19л, 19с;
г) 20р, 19л, 19с.
5. Скільки варіантів молекул CO2 можна отримати з таких нуклідів: Карбон-12, Оксиген-16, Оксиген-17?
6. Природний магній складається з ізотопів: 21Mg, 2oMg, 2iiMg. Обчисліть середню атомну масу природного магнію, якщо вміст цих ізотопів (в атомних %) становить 78,6; 10,1; 11,3 відповідно.
7. Бор має два ізотопи, атомна маса яких IOi 11. Відносна атомна маса Бору становить 10,82. Обчисліть відносний уміст кожного з ізотопів у природному борі (в атомних відсотках).
Підказка. Прийміть уміст (у%) одного ізотопу за х, тоді вміст другого — (100 - х).
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 20-09-2016, 23:56, Переглядів: 8370