§ 18. Кількість речовини, моль - одиниця кількості речовини. Число двогадро
Опанувавши матеріал параграфа, ви зможете:
• називати число Авогадро;
• знати поняття «кількість речовини», «моль», «число Авогадро»;
• формулювати визначення понять «кількість речовини», «моль», «число Авогадро»;
• обчислювати число молекул у певній кількості речовини; кількість речовини за відповідним числом молекул.
Пригадайте закон збереження маси речовин, з яким ви ознайомі лися в курсі хімії 7 класу.
Відомо, що речовини вступають у хімічні реакції в певнії кількісних співвідношеннях. Виникає питання: «Як прав тично взяти потрібну порцію речовини, що містить пеобхідн для хімічної реакції кількість атомів, молекул, йолів?» Прост відлічити потрібну кількість цих частинок практично немов· ливо через їх дуже малі розміри. Тому для проведення хімії них реакцій відміряють певні маси чи об'єми речовин. Macoi співвідношення речовин, що взаємодіють між собою, можи встановити, якщо звернутися до кількісного боку хімічне реакції.
Наприклад, запишемо реакцію взаємодії сірки з киснем:
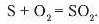
На основі відомих вам обчислень відносних атом ної та молекулярної мас з'ясуємо, у яких співвідношеннях ці речовини прореагують. З рівняння реакції стає очевидно, що 32 масові частини сірки (А, = 32) вступають у взаємодію а 32 масовими частинами кисню (Mr= 32). Отже, можна зробити висновок про те, що в порції сірки масою 32 г міститься така сама кількість частинок, що й у порції кисню масою 32 г. Інакше кажучи, обидві порції це однакові кількості речовини.
Кількість речовини. Для того щоб узяти для перебігу реакцій відповідні співвідношення порцій речовин, у хімії використовують фізичну величину кількість речовини.
Кількість речовини v (читається «ню») це фізична величина, що вказує на число структурних частинок (атомів, молекул, йопів), які містяться в даній порції цієї речовини.
Як і будь-яка фізична величина, кількість речовини має одиницю виміру. Такою одиницею є моль, що в перекладі з латинської означає «множина». Моль — це порція речовини, маса якої чисельно дорівнює її відносній атомній, молекулярній чи фор-мульній масам. Тому 1 моль сірки має масу 32 г, кисню — теж 32 г, вуглецю 12 г, натрій хлориду 58,5 г, води — 18 г.
Пригадайте, що називають нуклідом і що таке нуклід Карбону-12 —
,гС.
Моль це кількість речовини, що містить стільки структурних частинок (атомів, молекул, йопів), скільки атомів міститься в Карбоні масою 0,012 кг (12 г).
Число Авогадро. Італійський учений Amедео Аао/Лдро обчислив та експериментально дослідив число атомів у Карбоні з иуклонним числом 12, масою 0,012 кг (12 г), що відповідає кількості речовини вуглецю 1 моль. З цією метою він поділив цю масу па масу одного атома Карбону й отримав число 6,02 · 10й.

Hli честь ученого його називали числом Авогадро й позначають Na-Для кожної речовини, узятої порцією 1 моль, воно є незмінним.Тому число Авогадро (6,02 · IO2i) є універсальною сталою, що вказує па кількість структурних частинок у порції речовини 1 моль, для всіх речовин, незважаючи на їх агрегатні стани. Отже, у воді масою 18 г, у залізі масою 56 г, сірці масою 32 г містяться 6,02 1 IO2' структурних частинок. Звідси фізико-хімічну константу, що чисельно відповідає числу Авогадро, називають сталою Авогадро й теж позначають АГ1. Математично сталу Авогадро позначають таким відношенням:
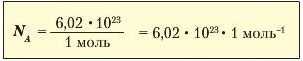
Розмірність сталої Авогадро 1/моль,або моль~1. Звідси випливає, що фізична величина І моль це авогадрове число структурних частинок речовини.
Число Авогадро 6,02 · 1023 це число, що вказує на кількість структурних частинок, яісі містяться в 1 моль будь-якої речовини, незалежно від її агрегатного стану.
Якщо кількість структурних частинок речовини N поділити па сталу Авогадро Na (тобто фізико-хімічну константу цього числа), то можна обчислити кількість речовини v:
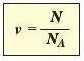
Зважаючи на те, що число 6,02 · IO23 є сталим для будь-якої речовини кількістю речовини 1 моль, то:
1 моль (O2) = 6,02 · IO23 молекул 1 моль (CO2) = 6,02 · IO2t молекул 1 моль (H2O) = 6,02 · 10й молекул
Обчислення на основі понять «кількість речовини» та «стала Авогадро».
Пригадайте, які структурні частинки речовини ви знаєте.
На основі поняття «кількість речовини» здійснюють обчислення, зокрема:
а) знаходять число структурних частинок у певній порції речовини;
б) за числом молекул (або інших структурних частинок) обчислюють відповідну кількість речовини.
Розглянемо приклади.
Задача 1. Обчисліть число молекул у воді кількістю речовини 0,2 моль. 1

ПІДСУМОВУЄМО ВИВ tIKiIE
{атомів, молекул, йонів), скільки атомів міститься в Карбоні масою 0,012 кг (12 г).
• Число Авогадро 6,02· 1023 — це число, що вказує на кількість структурних частинок, які містяться в порції 1 моль будь-якої речовини незалежно від її агрегатного стану.
• На основі понять «кількість речовини» та «стала Авогадро» здійснюють хімічні обчислення.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Сформулюйте визначення поняття «кількість речовини» й поясніть, що означає ця фізична величина.
2. Назвіть одиницю вимірювання кількості речовини та сформулюйте її визначення.
3. Поясніть спосіб, яким А. Авогадро обчислював число структурних частинок у 1 моль речовини та його фізичну суть.
4. Обчисліть число структурних частинок (атомів, молекул, йонів) у запропонованих порціях речовин:
а) 5 моль хлоридної кислоти НСІ; б) 2 моль натрій хлориду NaCI;
в) 3 моль карбон(І\/) оксиду CO2; г) 8 моль води H2O.
5. Обчисліть, якій кількості речовини відповідають запропоновані порції структурних частинок речовин:
а) 18,06 · 1023 води; б) 12,04 · 10а цинк оксиду;
в) 3,01 · 10мамоніаку; г) 24,08 · 10а азоту.
ЦІКАВО ЗНАТИ

Авогддро Амедео(1776-1856) — видатний італійський фізик і хімік. За освітою юрист, він почав самостійно вивчати фізику й математику. Успіхи у вивченні цих дисциплін і наполеглива праця з дослідження кількісного та якісного складу речовин дозволили вченому здобути посаду завідувача кафедри математичної фізики Туринського університету.
У 1811 р. дослідник відкрив закон, названий його іменем — закон Авогадро.Учений уточнив атомні маси деяких елементів, склад молекул багатьох газів, передбавив, що молекули простих речовин неметалів — двоатомні. На його честь число структурних частинок, що містяться в 1 моль будь-якої речовини, назвали числом Авогадро.
А. Авогадро — автор чотиритомної праці «Фізика вагових тіл, або Трактат про загальну конституцію тіл», який став першим посібником а мопею/пяоної Фізики.
- Кількість речовини. Розрахунки...
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 18-09-2016, 23:59, Переглядів: 2914