Кількість речовини
Матеріал параграфа допоможе вам:
• зрозуміти суть фізичної величини -кількість речовини», а також одиниці її вимірювання — моля;
• з'ясувати, скільки і яких частинок містить 1 моль речовини;
• розв’язувати задачі на обчислення або використання кількості речовини.
Кількість речовини. Вам відомо, що речовини мають різну будову — атомну, молекулярну, йонну. Перетворення одних речовин на інші відбуваються внаслідок сполучення атомів у моле-кули, розпаду молекул на атоми, перегрупування атомів або йонів. Коментуючи реакцію горіння вуглецю
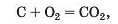
ви скажете, що кожний атом Карбону взаємодіє з однією молекулою кисню з утворенням молекули вуглекислого газу.
Щоб підготувати будь-який хімічний дослід, немає потреби перераховувати атоми, молекули реагентів. Це й неможливо зробити. Хіміки використовують фізичну величину, яка визначається кількістю найменших частинок речовини в певній її порції. Назва цієї величини — кількість речовини. Її позначають латинською літерою п; раніше для цього використовували грецьку літеру V («ню»).
Одиницею вимірювання кількості речовини є моль1.
Учені визначили, що 1 моль простої речовини атомної будови містить 602 000 000 000 000 000 000 000 атомів. Це число можна записати як 602 · IO21 (21 — кількість нулів у першому записі числа), або 6,02· IO23. В 1 моль речовини молекулярної будови міститься 6,02 · IO23 молекул15.
Скільки молекул міститься в 1/2 моль вуглекислого газу?
У разі йонних сполук і складних речовин атомної будови число 6,02· IO23 стосується груп частинок (йонів, атомів), наявних у хімічній формулі речовини. Такі групи частинок називають формульними одиницями речовин (с. 74). Для натрій хлориду NaCl формульною одиницею є катіон Na16 і аніон CT, а для силіцій(ІУ) оксиду SiO2 — атом Силіцію і два атоми Оксигену. Поняття «формульна одиниця» є універсальним;
його використовують також для молекулярних речовин, простих речовин атомної будови. Наприклад, формульна одиниця для води — молекула H2O, а для заліза — атом Феруму.
1 моль — порція речовини, яка містить 6,02 · 102;1 її формульних одиниць (атомів, молекул, груп атомів або йонів).
► Назвіть формульну одиницю для йонної сполуки Li2O. Скільки формульних одиниць міститься у 2 моль речовини?
Число 6,02 · IO23 обрано не випадково. Учені визначили, що саме стільки атомів міститься у 12 г найпоширенішого нукліда Карбону 12C.
1 моль — порція речовини, яка містить стільки її формульних одиниць, скільки атомів міститься у 12 г нукліда 12C.
Уявлення про порції різних речовин в 1 моль можна отримати з малюнка 38.
Поняття «кількість речовини» використовують не лише щодо речовин, а й щодо окремих частинок. Наприклад, 1 моль катіонів Ca2 — це 6,02 · IO23 таких йонів.
Число 6,02 · IO23 назвали числом Авогадро на честь італійського вченого А. Авогадро. Це число розраховували вчені, починаючи з другої половини XlX ст. Вони використовували результати різних досліджень.

Амедео Авогадро (1776—1856)

Видатний італійський фізик і хімік. Висунув гіпотезу про молекулярну будову речовин, зокрема газів. Відкрив один із законів для газів (1811), згодом названий його іменем. Уточнив атомні маси деяких елементів, визначив склад молекул води, амоніаку, вуглекислого і чадного газів, метану, сірководню тощо. Запропонував експериментальні методи визначення молекулярних мас газоподібних речовин.
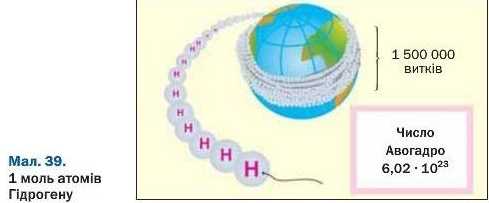
Число Авогадро в мільярди разів перевищує кількість волосин на головах, у вусах, бородах усіх людей, які живуть на Землі. Якщо вкрити земну поверхню такою кількістю (6,02 · IO23) тенісних м’ячиків, то товщина цього «покриття» становитиме приблизно 100 км. Якщо ж розмістити 6,02 · IO23 атомів Гідрогену, найменших серед усіх атомів, упритул один до одного в лінію, то її довжина становитиме приблизно 6 · IO10 км. Ниткою такої довжини можна обмотати земну кулю по екватору понад 1 500 000 разів (мал. 39).
Числу Авогадро відповідає стала Авогадро. Її позначення — Na, а розмірність випливає з такого виразу:
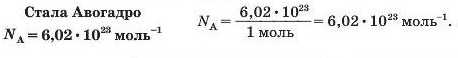
Виведемо формулу для обчислення кількості речовини за кількістю формульних одиниць.
Оберемо речовину молекулярної будови. Припустимо, що її порція містить N молекул. Міркуємо так:
в 1 моль речовини міститься Na молекул,
в п моль речовини — N молекул.
Звідси

Розв'язування задач. Розв'яжемо задачі, що потребують використання величини «кількість речовини».
ЗАДАЧА 1. У якій кількості речовини алюмінію міститься 3,01 · IO24 атомів?

В 1 моль будь-якої молекулярної речовини завжди міститься більше ніж 1 моль атомів. Наприклад, в 1 моль кисню O2 — 2 моль атомів Оксигену, а в 1 моль метану CH1 — 1 моль атомів Карбону і 4 моль атомів Гідрогену або δ моль усіх атомів.
► Які кількості речовини атомів містяться в 1 моль озону O3, у 2 моль білого фосфору P1, в 0,5 моль амоніаку NH3?
Кількості речовини йонів у йонній сполуці обчислюють аналогічно.
Отже, кількості речовини реагентів і продуктів відповідають (або пропорційні) коефіцієнтам у хімічному рівнянні. Це справедливо для будь-якої реакції. Наводимо ще один приклад :
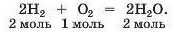
Кількість речовини в хімії визначають за кількістю її частинок (формульних одиниць).
Одиниця вимірювання кількості речовини — моль. 1 моль містить 6,02 · IO2s формульних одиниць речовини (атомів, молекул, rpjn атомів або йонів). Число 6,02 · IO2s називають числом Авогадро.
129. Із чим пов'язують кількість речовини в хімії? Назвіть одиницю вимірювання кількості речовини.
130. Визначте кількості речовини атомів кожного елемента:
а) в 1 моль брому Br2;
б) у 3 моль сірководню H2S;
в) в 1/3 моль фосфіну PH3. (Усно.)
131. Замість крапок вставте пропущені цифри:
а) у 3 моль води H2O міститься ... моль молекул,... моль атомів Гідрогену,... моль атомів Оксигену;
б) у 0,5 моль сульфатної кислоти H2SO4 міститься ... моль Гідрогену, ... моль Сульфуру,... моль Оксигену;
в) у 2 моль йонної сполуки Ca(OH)2 міститься ... моль йонів Ca2+ і... моль йонів ОН" або ... формульних одиниць.
132. Виконайте розрахунки і заповніть таблицю:
|
N(H3PO4) |
п(Н3Р04), моль |
п(Н), моль |
п(Р), моль |
п(0), моль |
|
12,04 · IO23 |
133. У якій кількості речовини вуглекислого газу містяться:
а) 3,01 · IO23 молекул;
б) 12,04 ■ IO23 атомів Оксигену?
134. Чи може 1 моль речовини містити більш ніж 6,02 · IO23 атомів? Відповідь поясніть і наведіть приклади.
135. Яка кількість речовини кальцій хлориду CaCI2 містить 3,01 · IO24 йонів Ca2*? Скільки йонів СІ" в такій порції сполуки? (Усно.)
136. У якій кількості речовини метану CH4 міститься стільки атомів, скільки їх:
а) в 1 моль оксиду P2O3;
б) у 0,3 моль кислоти HNO3;
в) у 2,5 моль оксиду CO?
137. У якій кількості речовини кухонної солі NaCI міститься стільки йонів, скільки їх:
а) у 0,2 моль оксиду CaO;
б) у 2 моль оксиду Li2O;
в) у 0,4 моль сполуки Na2S?
138. Назвіть співвідношення кількостей речовини елементів у речовинах із такими формулами: CaO, MgF2, HCIO4, Fe(OH)3. (Усно.)
139. Прокоментуйте хімічні реакції, використавши поняття -моль··:
а) S + 2СІ2 = SCI4; в) 2С0 + O2= 2С02.
б) N2 + ЗН2 = 2NH3;
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:50, Переглядів: 3395