§ 17. Ступінь окиснення
Опанувавши матеріал параграфа, ви зможете:
• розрізняти валептиість і ступінь окиснешія; ступінь окие-иеїшя і валентність елемента в простих і складних речовинах;
• розуміти сучасне поняття валентності; зміст поняття «ступінь окиснення»;
• складати формули бінарних сполук за ступенем окиснеш ія елементів;
• визначати ступінь окмсиенпя елементів за формулами бінарних сполук.
Ступінь окиснення. Вивчивши типи хімічного зв’язку в неорганічних речовинах, ви переконалися, що атоми можуть втрачати або приєднувати електрони в одних випадках й утворювати неподільні електронні пари в інших.
Пригадайте, на що вказує електронегативність атомів елементів, і як вона змінюється в періодах і групах.
Як вам відомо, електронегативність указує на те, до яких атомів у хімічній сполуці зміщуються або переміщуються електрони. З поняттям «електронегативність» нозв’язана ще одна характеристика атома ступінь окиснення.
Ступінь окиснення це умовний заряд атома в сполуці, якщо припустити, що вона складається тільки з йонів.
Кількісно ступінь окиснення визначають числом електронів, що віддав чи приєднав атом, якщо це йопна сполука. Наприклад, у сполуці складу ZnS атом Цинку віддав два електрони. Ступінь окиснення Цинку -2 (плюс два). Сульфур приєднав два електрони та внаслідок цього набув значення ступеня окиснення 2 (мінус два). Отже, у йоппих бінарних сполуках ступінь окис-иенпя чисел ьпо збігається з величиною заряду йонів. Ураховуючи той факт, що більшість неорганічних речовин мають немолеку-лярну будову, складати формули сполук доцільно за ступенем окиснення елементів.
У ковалентних полярних сполуках неподільна електронна пара зміщена до більш електронегативного елемента. Цей елемент має частковий негативний заряд. Відповідно елемент, від якого змістилася електронна пара, частково позитивний. Наприклад, у молекулі води H.,O до Оксигеиу зміщуються два .v-електроии від двох атомів Гідрогену. Внаслідок цього Гідроген отримує заряд «+» (плюс). Оксигеи набуває умовного заряду 2 (мінус два).
Ступені окислення у сполуках проставляють над символами елемеі па, напри клад:
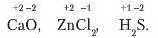
Треба запам'ятати, що. проставляючи ступінь окислення, спочатку ставлять знак «+» чи «·>, а потім його числове значення.
Пригадайте, як позначаються заряди йонів у йонних сполуках.
Справді, у йонних сполуках заряди йолів проставляють після символу елемента вгорі справа, причому спочатку пишуть числове значення, потім відповідний знак, наприклад: Ca2".
Цим відрізняються позначення заряду йола та ступеня окислення.
Валентність і ступінь окиснення. Вчення про будову атомів і хімічний зв’язок допомогло розкрити й зрозуміти фізичний зміст одного з основних понять хімії — валентності. Валентність розглядають як здатність атомів утворювати хімічні зв’язки.
Валентність це число ковалентних хімічних зв’язків, якими атом з’єднаний з іншими атомами.
З цього визначення можна зробити висновок про те, що число зв’язків, які може утворити атом, дорівнює числу песнаре-пих електронів, що використовуться на утворення спільних електронних нар. Отже, і валентність можна виражати числом неспарених електронів, які можуть утворити неподільні (спільні) електронні пари.
Якщо ж узяти до уваги те, що валентність вимірюється числом ковалентних зв'язків, то для речовин і іемол екуля P11 ої будов и поняття валентності втрачає визначеність. Для них характерне тільки поняття ступеня окиснення.
Що можна сказати про ступінь окиснення в сполуках із ковалентним неполярним зв’язком? Адже в них не відбувається зміщення електронів, а електроиегативність атомів, що утворюють молекули простих речовин, є однаковою. Вам уже відомо, що в таких сполуках ядра атомів рівповіддалеиі від спільних електронних пар, що утворюють зв'язок. Тому ступінь окиснення в простих речовинах дорівнює нулю, наприклад, для простих речовин, утворених немета'іічними елементами Гідрогеном, Хлором, Оксигеном і т. д.:
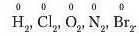
Однак валентність атомів елементів не співпадає а числовим значенням ступеня окислення, оскільки, як уже вгадувалося, валентність визначається числом електронів, що утворюють хімічний зв’язок. Тому у вищевказаних сполуках водню, хлору, брому валентність елементів дорівнює 1, у кисню — 2, а в азоту — 3.
Звідси випливає висновок: у простих речовинах, до складу молекул яких входять два атоми, ступінь окислення та валентність елементів неоднакові.
Треба зазначити, що багато елементів у сполуках проявляють змінний ступінь окислення. Наприклад, Сульфур у сполуках H2S, Na2S проявляє ступінь окислення 2, бо має більшу електропсга-тивиість, аніж Гідроген і Натрій. А в сполуках SO.,, SO,. Сульфур проявляє позитивний ступінь окислення, відповідно +4 і +6, бо Оксиген більш електронегативний. Найвищий позитивний ступінь окислення елемента виявляється тоді, коли всі електрони зовнішнього енергетичного рівня утворюють хімічні зв’язки.
Враховуючи те, що молекули електронейтральні, сума позитивних зарядів дорівнює сумі негативних зарядів усередині однієї молекули.
Визначення ступеня окиснення елемента за хімічною формулою сполуки. За хімічною формулою бінарної сполуки визначають ступінь окиснення елемента. Щоб цезробити, необхідно пам’ятати:
1) у формулах бінарних сполук елемент із більшою електро-негативністю стоїть на другому місці. Це означає, що електронна пара зміщена до цього елемента. У разі йопиих сполук електрони перемістилися до цього елемента. Отже, його ступінь окиснення завжди матиме негативний заряд, числове значення якого залежить від кількості зміщених або переміщених електронів;
2) сума ступенів окиснення елементів у сполуці дорівнює нулю;
3) ступінь окиснення лужних металічних елементів завжди дорівнює +1, а Гідрогену переважно теж +1 (виняток становлять сполуки металічних елементів з Гідрогеном гідриди, у яких ступінь окиснення 1);
4) ступінь окислення Оксигену —2 (виняток: сполуки OFv, H2O2);
5) ступінь окиснем її ія елемента в простій речовині лорівшос нулю.
Зважаючи на сказане вище, спробуйте визначити ступінь окис-нення елемента в бінарних сполуках за поданими формулами.
HBr, CaO, Mn2O7, CH4, NH3, H2S.
Складання формули сполуки за відомими ступенями окис-
НЕННЯ ЕЛЕМЕНТА.
Пригадайте, як складають формули бінарних сполук за валентністю атомів елементів.
Аналогічно, як за валентністю атомів елементів, складають (}юр-мули, використовуючи поняття «ступінь окислення».
Розглянемо при клад.
Завдання 1. Складіть формулу сполуки Хлору, що проявляє ступінь окислення +7, з Оксигеном.
Pозв’язан її я.
1. Запишемо символи хімічних елементів і проставимо числові значення їх ступенів окиснеиня:
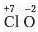
2. Знайдемо найменше спільне кратне для чисел 7 і 2, воно становить 14.
3. Поділимо найменше спільне кратне па ступінь окиснеиня кожного елемента й знайдемо число атомів у складі сполуки, які проставляються індексами.
4. Відповідь: формула сполуки — Cl2Or
ПІДСУМОВУЄМО ВИВ ЧЕІІЕ
• Ступінь окиснеиня — це умовний заряд атома в сполуці, якщо припустити, що вона складається тільки з йонів.
• Ступінь окиснеиня визначають числом електронів, що віддав чи приєднав атом, якщо це йонна сполука, або числом зміщених електронів, якщо сполука ковалентна полярна.
• У простих речовинах, до складу молекул яких входять два атоми, ступінь окиснеиня та валентність елементів різні.
• За хімічною формулою бінарної сполуки визначають ступінь окиснеиня елемента, а за ступенем окиснеиня — складають формули бінарних сполук.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Сформулюйте визначення поняття «ступінь окиснення».
2. Поясніть, як визначити ступінь окиснення елементів у йонних і ковалентних сполуках.
3. Обчисліть ступені окиснення елементів у сполуках, поданих формулами:
a) AgCl1 CO2, C112S, NO2, АІ2О3; б) FeCl3, NO: Ag2S, СГ2О3, Р2О5; в) СаВгг, Мп20з, Na20, N203, CO; г) Np, СгОз, К2О, МП2О7, N2O; ґ) Na2S1 N2O5, ZnCI2, CCI4, SO3; д) AICI3, CuS, CI2O3, MnO3, OF2.
4. Складіть формули бінарних сполук за ступенями окиснення елементів між: а) Кальцієм і Хлором; б) Магнієм і Сульфуром; в) Калієм та Оксигеном; г) Літієм і Нітрогеном; ґ) Барієм і Бромом; д) Алюмінієм й Оксигеном; е) Карбоном і Гідрогеном; є) Магнієм і Нітрогеном.
5. Обчисліть ступінь окиснення елементів у кислотах, поданих формулами, знаючи, що ступінь окиснення Гідрогену +1, а Оксигену -2: H3PO4, HNO3, H2SO4, HCIO4, H2MnO4lHPO3.
ДОСЛІДЖУЄМО ВДОМА
Дослід 1. Нашатирний спирт є розчином амоніаку у воді. Його використовують для відновлення свідомості під час втрати її людиною. З цією метою нашатирний спирт тримають у домашній аптечці. Дослідіть фізичні властивості цієї речовини й зробіть висновок про ТИП хімічного зв'язку в молекулі амоніаку.
Дослід 2. Дослідіть, чому убережжя річок і морів, що вкриті ПІСКОМ, не взаємодіють з водою. Які ще фізичні властивості притаманні силіцій(І\/) оксиду?
Дослід 3. Цей продукт, солоний на смак, — життєво необхідний для людини. Назвіть його та дослідіть фізичні властивості.
НАВЧАЛЬНИЙ ПРОЕКТ
Залежність фізичних властивостей речовин від типів кристалічних ґраток.
I. Виконайте навчальний проект у довільній формі.
II. Проведіть презентацію проекту.
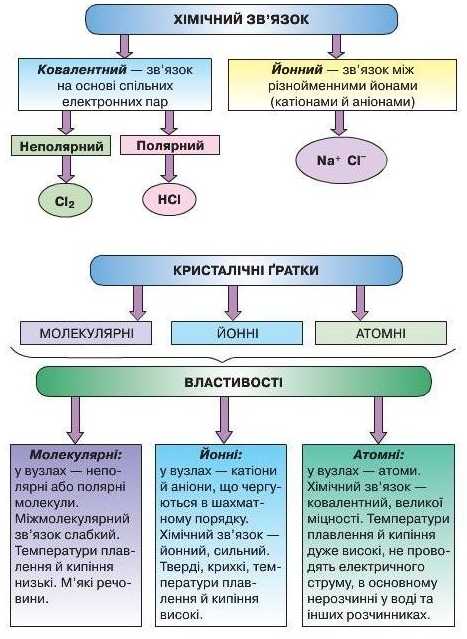
УЗАГАЛЬНЕННЯ ЗНАНЬ ІЗ ТЕМИ 2
«ХІМІЧНИЙЗВ'ЯЗОК ІБУДОВЛ РЕЧОВИНИ>
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 18-09-2016, 23:58, Переглядів: 2959