§ 21. Ступінь окиснення елементів
Пригадайте визначення електронних конфігурацій атомів (за § 13).
Поняття про ступінь окиснення
Для характеристики хімічних реакцій часто є необхідність зазначити число електронів, що беруть участь у тому чи іншому процесі. Якщо для речовин з йонним зв’язком для цього достатньо знати заряди утворених йонів, то в речовинах з ковалентним зв’язком визначити заряди досить складно. Тому для всіх сполук, незалежно від типу їхнього хімічного зв’язку, застосовують більш універсальне поняття — ступінь окиснення.
Ступінь окиснення визначається числом відданих або прийнятих електронів у речовинах з йонним зв’язком та числом електронів у складі спільних електронних пар, що зумовлюють ковалентний полярний зв’язок.
Ступінь окиснення — це умовний заряд на атомі в молекулі або кристалі, обчислений з припущенням, що всі спільні електронні пари повністю зміщені в бік більш електронегативного елемента.
У найпростіших йонних сполуках ступінь окиснення збігається із зарядами йонів, наприклад:
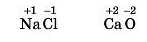
Це правило поширюється на всі основні оксиди: ступінь окиснення металічного елемента дорівнює заряду йона металічного елемента (Натрію +1, Барію — +2, Алюмінію +8), а ступінь окиснення Оксигену дорівнює -2.
У сполуках з ковалентним полярним зв’язком роблять припущення, що спільна електронна пара повністю переходить до більш електронегативного елемента. У цьому випадку в гідроген флуориді та воді ступені окиснення будуть такі:
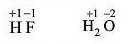
Ступінь окиснення позначають арабською цифрою, що пишуть над символом елемента, причому спочатку вказують знак заряду, а потім його чисельне значення. Якщо модуль ступеня окиснення дорівнює одиниці, то число «1» можна не стішити і писати тільки знак: NaCl-
Можливі ступені окиснення елементів
Ступені окиснення, які елементи можуть виявляти в різних сполуках, у більшості випадків можна визначити за будовою зовнішнього електронного рівня або за положенням елемента в Періодичній системі.
Атоми металічних елементів можуть тільки віддавати електрони, тому в сполуках вони виявляють позитивні ступені окиснення. Максимальне значення — вищий ступінь окиснення — зазвичай дорівнює числу електронів на зовнішньому рівні, а отже й номеру групи в Періодичній системі.
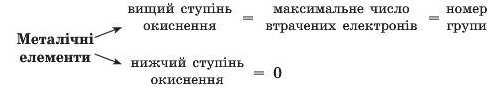
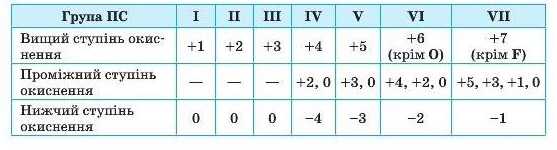
Атоми неметалічних елементів можуть виявляти як позитивний, так і негативний ступінь окиснення. Максимальний позитивний ступінь окиснення — вищий ступінь окиснення — як і для неметалічних елементів дорівнює числу валентних електронів. А нижчий ступінь окиснення визначається тим, скільки електронів бракує атому, щоб на зовнішньому рівні їх було вісім (табл. 7).

Окрім вищого та нижчого ступеня окиснення багато елементів можуть також виявляти й проміжні ступені окиснення. Визначити їх для S- та p-елементів допоможе таблиця 7.
Таблиця 7. Найбільш характерні ступені окиснення 8- та D-ЄЛЄМЄНТІВ
Деякі хімічні елементи не підпадають під ці правила. Серед них Гідроген, Оксиген, Флуор:
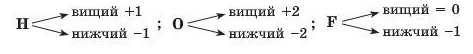
Визначення ступенів окиснення в бінарних сполуках
Для визначення ступенів окиснення у сполуках недостатньо знати можливі ступені окиснення елементів. Для цього слід користуватися певними правилами. Насамперед принципом електронейтральності: оскільки будь-яка речовина є електронейтральною, то сума ступенів окиснення атомів усіх елементів, з яких складається речовина, має* дорівнювати нулю.
Наприклад, визначимо ступені окиснення в сульфур(ІУ) оксиді SO2. В оксидах ступінь окиснення Оксигену завжди дорівнює —2. Отже, для того щоб нейтралізувати заряд на двох атомах Оксиге-
+4 -2
ну у Сульфуру ступінь окиснення має бути +4: SO2 ·
Алгоритм визначення ступеня окиснення елементів у бінарних сполуках (на прикладі фосфор(У) сульфіду та кальцій фосфіду)
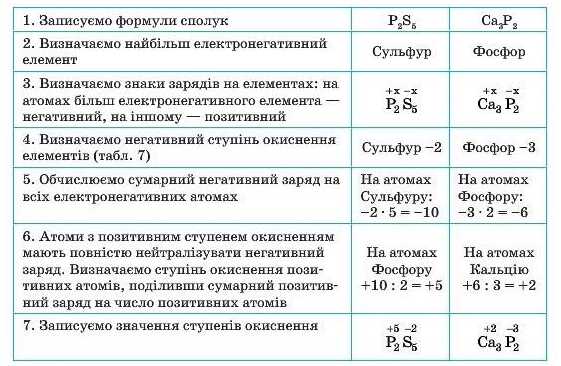
Висновки
1. Ступінь окиснення визначає число прийнятих або відданих електронів. Для одноатомних йонів ступінь окиснення дорівнює заряду йону. В інших випадках він дорівнює заряду на атомі в молекулі або кристалі, обчисленому з припущенням, що всі спільні електронні пари повністю зміщені в бік більш електронегативного елемента.
2. При визначенні ступеня окиснення слід пам’ятати, що сума ступенів окиснення всіх атомів у сполуці дорівнює нулю. В атомів більш електронегативного елемента у сполуці ступінь окиснення негативний, а в інших атомів — позитивний.
Контрольні запитання
1. Дайте визначення поняттю «ступінь окиснення».
2. У чому полягає спільність і відмінність понять «ступінь окиснення» і «валентність»?
3. Як можна визначити вищий, нижчий та проміжні ступені окиснення елементів за Періодичною системою?
4. Чому дорівнює нижчий ступінь окиснення металічних елементів?
5. Сформулюйте алгоритм визначення ступенів окиснення елементів у бінарних сполуках.
6. Який ступінь окиснення елементів у простих речовинах? Чому він саме такий?
Завдання для засвоєння матеріалу
1. Визначте валентність і ступінь окиснення всіх елементів за наведеними структурними формулами:
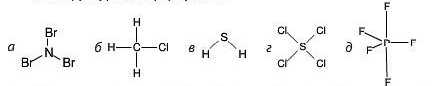
2. За положенням елементів у Періодичній системі визначте можливі валентності і ступені окиснення: а) Калію; 6) Магнію; в) Брому; г) Фосфору; д) Сульфуру.
3. Визначте ступені окиснення елементів у сполуках з Гідрогеном: CH4, NH3, HjS, HO, CaHj.
4. Визначте ступені окиснення елементів у речовинах:
а) AIF3, BaCI2, CaS, K3P, SnO2; г) CF4, Ca, CS2, AI4C3, PCIs;
б) I2, N2O3, PbCI4, CI2O,, SbCI3; д) FeS, ІВг, TeCI4, SF6, NF3;
в) Brl3, NaF, P4, Cul2, MgS; е) CS2, XeO4, CCI4, PCIs, Mn2O7.
5. Наведіть формули речовин, у яких ступені окиснення Гідрогену й Карбону дорівнюють їхнім валентностям.
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:58, Переглядів: 8313