§ 22. Застосування поняття про ступінь окиснення
Визначення ступенів окиснення в кислотах, гідроксидах та солях
Для сполук, утворених більше ніж двома хімічними елементами, принцип електронейтральності також є основним. І підхід для визначення ступенів окиснення такий самий, як і для бінарних сполук. Також слід пам’ятати, що в переважній більшості сполук ступінь окиснення Оксигену —2, а Гідрогену +1.
Для визначення ступенів окиснення в кислотах та гідроксидах можна скористатися таким алгоритмом:
Алгоритм визначення ступенів окиснення елементів у кислотах та гідроксидах (на прикладі сульфатної кислоти та хром(ІІІ) гідроксиду)
|
1. Записуємо формули речовин |
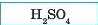 |
 |
|
2. Підписуємо ступені окиснення Оксигену та Гідрогену |
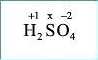 |
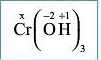 |
|
3. Складемо рівняння для обчислення невідомого заряду. Слід пам’ятати, що ступінь окиснення — це заряд на одному атомі. Якщо атомів певного елемента більше одного, то його заряд слід помножити на число атомів |
 |
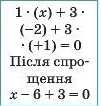 |
|
4. Розв’язуємо складене рівняння |
 |
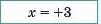 |
|
5. Підписуємо визначений ступінь окиснення |
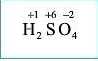 |
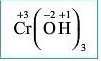 |
Розглянемо, як визначити ступені окиснення трьох елементів, на прикладі калій сульфіту K0SOlj. Ступінь окиснення Калію у сполуках може бути тільки +1 (табл. 7, с. 109), а Оксигену--2:
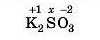
Оскільки сума зарядів має дорівнювати нулю, то обчислимо ступінь окиснення Сульфуру, розв’язавши рівняння:
2 · (+1) + 1 · (х) + 3 · (-2) = 0, звідки х = +4 При визначенні ступенів окиснення елементів у сполуках слід дотримуватися правил:
1. Ступінь окиснення елемента в простій речовині дорівнює нулю.
2. Флуор — найбільш електронегативний хімічний елемент, тому ступінь окиснення Флуору в усіх сполуках дорівнює —1.
3. Оксиген — найбільш електронегативний елемент після Флуору,
тому ступінь окиснення Оксигену у всіх сполуках, крім флуоридів, негативний: у більшості випадків він дорівнює -2, а в пероксидах--1.
4. Ступінь окиснення Гідрогену в більшості сполук дорівнює +1,
а в сполуках з металічними елементами (гідридах)--1.
δ. Ступінь окиснення металічних елементів у сполуках завжди позитивний.
6. Більш електронегативний елемент завжди має негативний ступінь окиснення.
7. Сума ступенів окиснення всіх елементів у сполуці дорівнює нулю.
Складання формул сполук за ступенем окиснення елементів
Використовуючи ступені окиснення, складати формули бінарних сполук простіше, ніж за валентністю. При складанні формул слід керуватися правилом електронейтральності.
Алгоритм складання формул сполук за відомими ступенями окиснення елементів (на прикладі сульфур(УІ) оксиду
та фосфор(ІП) хлориду)
|
1. Записуємо символи елементів у необхідному порядку та надписуємо їхні ступені окиснення |
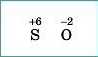 |
 |
|
2. Визначаємо найменше спільне кратне (HCK) для значень ступенів окиснення (на знак не звертаємо увагу) |
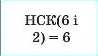 |
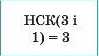 |
|
3. Число атомів певного елемента дорівнює відношенню HCK до ступеня окиснення цього елемента |
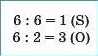 |
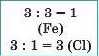 |
|
4. Записуємо індекси після символів елементів |
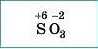 |
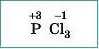 |
Висновки
1. При визначенні ступеня окиснення в кислотах, основах та солях слід зважати на те, що ступінь окиснення Оксигну завжди -2, а Гідрогену — +1. Ступінь окиснення інших елементів обчислюється за принципом електронейтральності.
2. Позитивний заряд на всіх атомах має бути скомпенсований негативними зарядами інших атомів.
Завдання для засвоєння матеріалу
1. Складіть формули сполук, використовуючи ступені окиснення елементів: а) 6ром(І) оксид; б) манган(ІІ) оксид; в) станум(ІУ) оксид; г) ферум(ІІІ) оксид; д) xnop(VII) оксид.
2. Визначте ступені окиснення всіх елементів у таких сполуках:
а) CrCIjf KCIOjf BaCIy Ca(CIO)y HCIO4, AIj(SO4)jf FejOj, NaOH;
б) Ba(OH)jf Ca(NO3)2f H2CO3, HNOjf H2S, H3PO4, HCIOf H2SO4;
в) KCIO3, K2Cr2O,, Na2SO3, KCIO3, NaCI, Na2CrO4, NH4CIO4, BaMnO4.
3. Визначте ступені окиснення Мангану в сполуках: Mn, MnO1 MnO2, K2MnO4, KMnO4, Mn2Or
4. Обчисліть ступені окиснення Карбону в сполуках: CH4, CH3CIf CH2CI2, C2HljCIf C2H2CI4, C2CI6. (Візьміть до уваги, що в усіх цих сполуках ступінь окиснення Гідрогену +1, а Хлору -1).
5. Визначте електронну конфігурацію Хлору у ступенях окиснення: -I, Of +1, +3, +5, +7.
6. Наведіть формули сполук Нітрогену з позитивним і негативним ступенем окиснення цього хімічного елемента.
7*. Максимальна валентність та ступінь окиснення Оксигену та Флуору відрізняються від номера групи Періодичної системи, у яких вони розташовані. Як ви вважаєте, чим це можна пояснити?
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:58, Переглядів: 2003