§ 6. Периодический закон Д. И. Менделеева
Вспомните:
• высшую валентность элементов можно определить по номеру группы Периодической системы, в которой расположен элемент;
• отличить металл от неметалла можно, основываясь на общих физических свойствах металлов: ковкость, металлический блеск, электропроводность, теплопроводность и т. п.;
• как можно определить химический характер оксидов (§ 1).
Открытие Периодического закона
В отличие от своих предшественников, Д. И. Менделеев был глубоко убежден в существовании взаимосвязи между всеми химическими элементами: как между сходными, так и между несходными.

В середине XIX в. Менделеев начал работать над своим знаменитым учебником «Основы химии», и ему необходимо было определить, в каком порядке описывать свойства элементов. За основу систематизации элементов Менделеев взял относительную атомную массу, считая, что она является главной характеристикой химического элемента: она не изменяется при образовании элементом простого или сложного вещества.
Расположив в ряд символы всех известных к тому времени химических элементов в порядке увеличения их относительной атомной массы, он заметил, что элементы со сходными свойствами (например, щелочные элементы) не расположены непосредственно друг за другом, а появляются периодически (регулярно). Оказалось, что так же закономерно (через определенный интервал) повторяется химический характер соединений элементов.
Проанализируем, какие закономерности можно выявить при расположении элементов в ряд (табл. 3, с. 28-29).
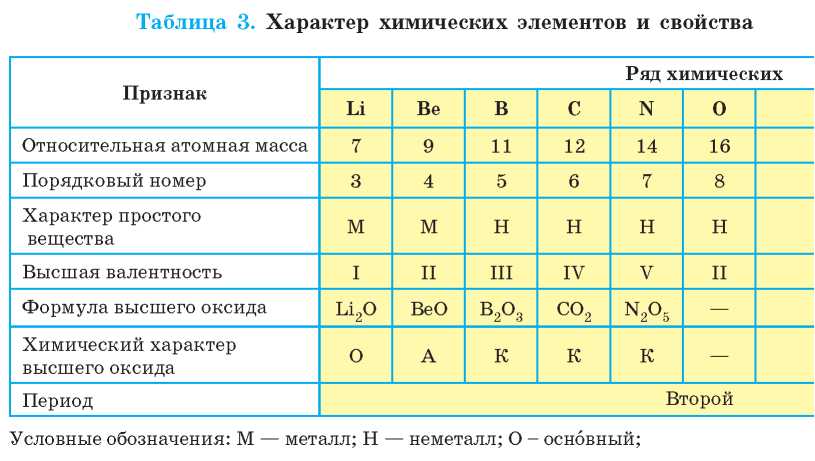
В ряду элементов, приведенных в таблице 3, четко прослеживается периодическое изменение признаков. Так, Литий образует простое вещество металл. Постепенно характер простых веществ меняется на неметаллический. Также постепенно увеличивается высшая валентность, которую проявляют элементы, и химический характер их оксида. Литий оксид является основным, а нитроген^) оксид — кислотным (Оксиген, Флуор и Неон не способны образовывать оксиды).
Затем эта последовательность в изменении свойств резко обрывается. Появляется элемент Натрий, который по свойствам схож с первым элементом ряда — Литием. Далее свойства элементов изменяются так же, как и от Лития до Флуора. В ряду простых веществ происходит постепенное изменение: от типичного металла (натрия) до типичного неметалла (хлора). Наблюдается также изменение состава и характера свойств соединений, в частности переход от основного натрий оксида к кислотному хлор(УП) оксиду.
Анализируя эту последовательность элементов, Д. И. Менделеев установил, что зависимость свойств элементов и их соединений от атомной массы является периодической. В 1869 г. он сформулировал Периодический закон.
Свойства химических элементов, а также образованных ими простых и сложных веществ находятся в периодической зависимости от относительных атомных масс элементов.
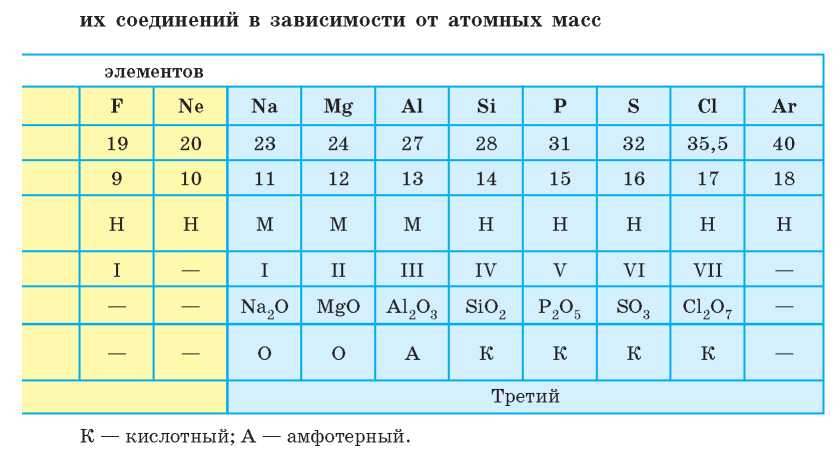
Располагая известные элементы по увеличению относительной атомной массы, Менделеев заметил противоречия между массой и положением Аргона и Калия. Относительная атомная масса Калия равна 39,1, а Аргона — 39,95. Если располагать их по значению относительных атомных масс A , получим:
|
Группа ПС |
VII |
VIII |
I |
II |
|
Химический элемент |
Cl |
K |
Ar |
Ca |
|
Л |
35,45 |
39,1 |
39,95 |
40,08 |
|
Высшая валентность |
VII |
I |
- |
II |
|
Характер элемента |
Неметаллич. |
Металлич. |
Инертный |
Металлич. |
|
Если же вопреки атомным массам поменять местами Калий и Аргон, противоречие исчезает: |
||||
|
Группа ПС |
VII |
VIII |
I |
II |
|
Химический элемент |
Cl |
Ar |
K |
Ca |
|
A |
35,45 |
39,95 |
39,1 |
40,08 |
|
Высшая валентность |
VII |
- |
І |
II |
|
Характер элемента |
Неметаллич. |
Инертный |
Металлич. |
Металлич. |
Этот парадокс с «неправильным» размещением элементов был объяснен только в начале XX в. после открытия строения атома. Но на тот момент без знаний о строении атома это был очень смелый
поступок. Если вы внимательно рассмотрите современную Периодическую систему, то сможете найти еще два примера таких исключений в расположении химических элементов.
Изначально формулировка закона Д. И. Менделеева была несколько иной: «Свойства простых тел, а также форма и свойства соединений элементов находятся в периодической зависимости или, выражаясь алгебраически, образуют периодическую функцию от величины атомного веса элементов». В те времена вместо «вещество» говорили «тело», а атомную массу называли атомным весом.
От ряда элементов к Периодической системе
Итак, ряд химических элементов, расположенных по увеличению их относительных атомных масс, можно разделить на отдельные участки. Каждый участок начинается щелочным элементом, а заканчивается инертным. Такие участки называют периодами. Периоды, расположенные друг под другом, образуют уже знакомую вам Периодическую систему химических элементов (рис. 6.2).
Ряд химических элементов, расположенных в порядке возрастания их атомных масс, начинающийся с Гидрогена или щелочного металлического элемента и заканчивающийся инертным элементом, называют периодом.
Характер элементов и свойства их простых веществ и соединений при увеличении атомных масс в периоде постепенно изменяются.
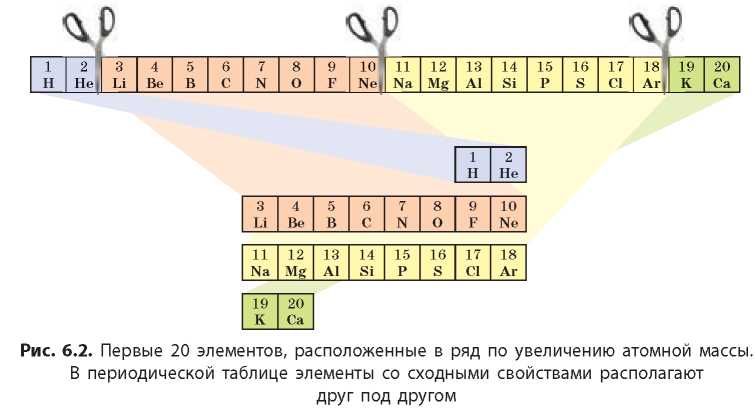
Первый период содержит только два элемента, второй и третий — по восемь. Эти периоды называют малыми. В них при переходе от Гидрогена или щелочного металлического элемента к инертному элементу высшая валентность элементов постепенно увеличивается от I (у Гидрогена и щелочных металлических элементов) до VII (у галогенов). Если бы удалось получить соединения инертных элементов Неона и Аргона, то их максимальная валентность была бы равна VIII.
В отличие от первых трех периодов, четвертый и последующие периоды (пятый, шестой, седьмой) содержат по 18 и больше элементов, поэтому их называют большими.
В больших периодах также наблюдается постепенное изменение свойств. Но если в малых периодах переход от типичного металлического элемента к типичному неметаллическому элементу происходит за семь элементов, то в больших периодах такой же переход происходит за 17 или 31 элемент. То есть в больших периодах изменение свойств происходит значительно медленнее: характер соседних элементов в больших периодах отличается не так значительно, как у соседних элементов малых периодов.
Существует легенда, будто идея о Периодической системе пришла к Менделееву во сне. Однажды его спросили, так ли это, на что ученый ответил:
«Я над ней, может, двадцать лет размышлял, а вы думаете: сидел и вдруг... готово».
Выводы
1. Характер химических элементов и свойства образованных ими соединений находятся в периодической зависимости от их атомных масс. Все химические элементы разделяют на периоды, каждый из которых начинается щелочным элементом (или Гидрогеном) и заканчивается инертным элементом.
2. В периоде ослабляется металлический характер элементов и усиливается неметаллический. Так же изменяется и характер соединений элементов: соединения элементов, расположенных в начале периода, проявляют основные свойства, а в конце периода — кислотные.
Контрольные вопросы
1. Сформулируйте Периодический закон.
2. Какие свойства элементов и их соединений изменяются периодически?
3. Что называют периодом химических элементов?
4. Какие периоды называют малыми? большими? Почему их называют именно так?
5. Чем отличается изменение характера элементов в больших и малых периодах?
6. В какой части периода расположены элементы, относящиеся к семействам: а) щелочных элементов; б) галогенов; в) инертных элементов?
Задания для усвоения материала
1. Найдите в Периодической системе элементы, расположенные не в порядке увеличения относительной атомной массы. Какие противоречия появятся, если их расположить согласно их атомным массам?
2. Как изменяется характер оксидов элементов в периоде? Проиллюстрируйте уравнениями реакций свойства оксидов Лития и Карбона. Какие свойства характерны для их гидратов?
3. Составьте формулы высших оксидов и гидратов оксидов элементов третьего периода. Укажите характер этих соединений (кислотный или основный).
4. Элемент в Периодической системе имеет порядковый номер 16. Какими свойствами обладают его оксиды, соответствующие высшей и низшей валентности? Образует ли этот элемент соединения с Гидрогеном?
5. Проанализируйте положение в Периодической системе элементов, способных образовывать летучие соединения с Гидрогеном (см. форзац 1). Проявление элементом каких свойств свидетельствует об образовании им летучего соединения с Гидрогеном?
6. До конца 60-х гг. XIX в. два элемента — А и Б — считали двухвалентными металлическими элементами и приписывали им неправильные атомные массы. Не найдя для них в Периодической системе места, которое соответствовало бы их свойствам, Д. И. Менделеев увеличил в полтора раза значения их атомных масс и уточнил валентность каждого из них, и тогда место для них нашлось. Неправильные атомные массы, которые приписывались элементам, были следующие: у элемента А — около 60, а у элемента Б — немногим больше 90. Найдите им место в Периодической системе и назовите эти элементы.
7. Выполните учебный проект № 1 «Из истории открытия Периодической системы химических элементов».
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:25, Переглядів: 3343