§ 7. Периодическая система химических элементов
Короткий и длинный варианты графического представления Периодической системы
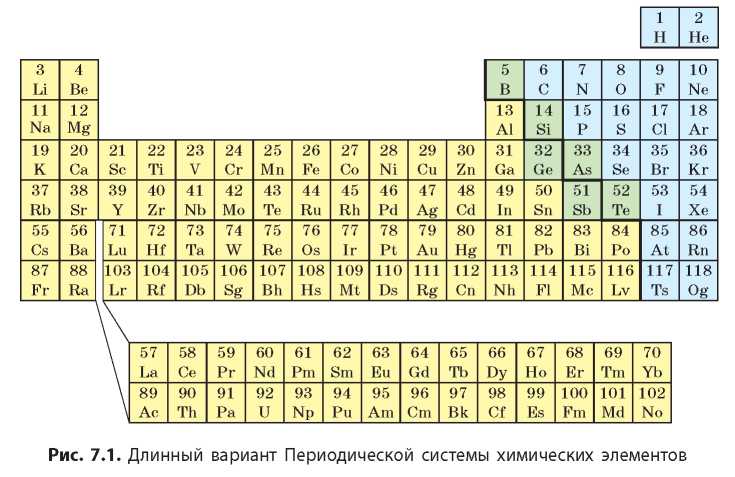
Основываясь на Периодическом законе, Д. И. Менделеев создал классификацию химических элементов, которую называют Периодической системой. Обычно ее представляют в виде таблицы. В настоящее время чаще используют два варианта графического представления Периодической системы: короткий и длинный. Д. И. Менделеев чаще использовал более компактный короткий вариант Периодической системы (см. форзац 1). В нем большие периоды разбиты на две строки, в каждой из которых высшая валентность элементов последовательно увеличивается от I до VIII.
Если же записать символы элементов каждого периода в отдельную строку так, чтобы каждое семейство элементов (щелочные элементы, галогены, инертные элементы) образовывало отдельный столбец, то получим длинный вариант Периодической системы (рис. 7.1). Этот вариант был предложен Альфредом Вернером значительно позже открытия Периодического закона.
Группы элементов. Главные и побочные подгруппы
Вертикальные столбцы Периодической системы называют группами. В коротком варианте системы номера групп обозначают римскими цифрами, а число групп равно восьми. Номер группы обычно совпадает с высшей валентностью химического элемента.
Каждую группу разделяют на две подгруппы — главную и побочную. К главной подгруппе относятся элементы как малых, так и больших периодов, а к побочной — только больших.
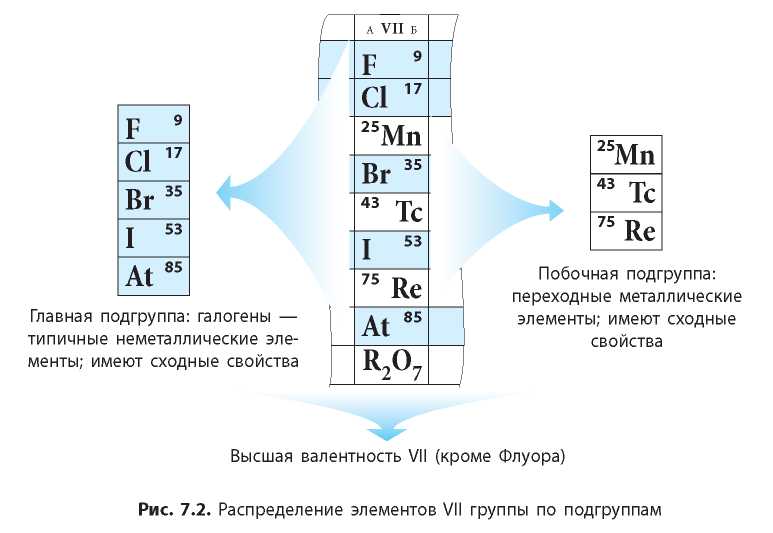
Главные подгруппы также называют А-группами, а побочные — В-группами. Например: Флуор расположен в группе VI^, а Манган — в группе VIIb (рис. 7.2). Побочные подгруппы содержат только металлические элементы (их называют переходными металлическими элементами).
В нижней части периодической таблицы расположены семейства лантаноидов и актиноидов. Это элементы, которые должны быть размещены после Лантана (№ 57) и Актиния (№ 89) и также относятся к III группе (подгруппе Скандия). Однако размещение этих элементов в таблице сделало бы ее громоздкой и неудобной, поэтому обычно их выносят за ее пределы.
В большинстве европейских стран пользуются длинным вариантом периодической таблицы, в котором число групп равно 18. Номера групп в длинном варианте таблицы обозначают арабскими цифрами. В длинном варианте главных и побочных подгрупп нет, там они образуют отдельные группы, например: группа 1 — щелочные элементы, группа 17 — галогены, группа 18 — инертные элементы. Элементы побочных подгрупп размещены в группах от 3 до 12. Обратите внимание, как соотносятся номера групп в разных вариантах периодической таблицы: номер группы в коротком варианте равен номеру в длинном минус 10.
Свойства элементов в подгруппах
Подгруппы образованы элементами со сходными свойствами: семейства щелочных и инертных элементов, галогенов — именно они и составляют отдельные подгруппы. Многие свойства элементов в подгруппах закономерно изменяются с увеличением относительной атомной массы. В главных подгруппах при увеличении атомной массы усиливаются металлические свойства элементов и образованных ими простых веществ, а неметаллические — ослабевают. Так, в подгруппе Карбона (главная подгруппа IV группы) Карбон и Силиций являются неметаллическими элементами, Германий — полуметаллическим, а Станнум и Плюмбум — металлическими.
Сходными свойствами обладают лишь элементы, относящиеся к одной подгруппе. Свойства элементов главной и побочной подгрупп одной группы могут существенно отличаться. Например, в VII группе расположены галогены — типичные неметаллические элементы (главная подгруппа) и переходные металлические элементы Манган, Технеций, Рений (побочная подгруппа) (рис. 7.2).
Есть ли между ними что-то общее? Обычно у элементов одной группы одинаковая высшая валентность, которую они проявляют в соединениях с Оксигеном, — она равна номеру группы.
Соединения с Гидрогеном образуют почти все элементы, но летучие соединения образуют только неметаллические элементы. Такие соединения являются веществами молекулярного строения. Металлические элементы не способны образовывать летучих соединений с Гидрогеном.
В соединениях с Гидрогеном неметаллические элементы проявляют свою низшую валентность. Чтобы ее определить, необходимо от 8 отнять номер группы. Например, Хлор, расположенный в VII группе, в соединении с Гидрогеном одновалентен (8 - 7 = 1), поэтому формула данного соединения — HCl. Элемент V группы Фосфор в соединении с Гидрогеном трехвалентен (8 - 5 = 3), поэтому формула соединения — PH3.
|
Группа ПС |
І |
ІІ |
ІІІ |
IV |
V |
VI |
VII |
|
Высшая валентность |
I |
II |
III |
IV |
V |
VI |
VII |
|
Высший оксид |
R2O |
RO |
R2O3 |
RO2 |
R2O5 |
RO3 |
R2O7 |
|
Низшая валентность |
IV |
III |
II |
I |
|||
|
Летучее соединение с Гидрогеном |
RH4 |
RH3 |
H2R |
HR |
Для удобства общие формулы высших оксидов и летучих соединений с Гидрогеном вынесены в отдельные строки периодической таблицы (см. форзац 1). Необходимо помнить, что формулы летучих соединений с Гидрогеном относятся только к неметаллическим элементам.
Выводы
1. Графическим отображением Периодического закона является Периодическая система. Наиболее распространены ее короткий и длинный варианты. Они отличаются числом строк, отведенных на один период. В длинном варианте каждый период занимает одну строку, а в коротком малые периоды расположены в одну строку, а большие — в две.
2. Группа химических элементов — это вертикальный столбец, объединяющий элементы со сходными свойствами. В коротком варианте Периодической системы каждая группа делится на главную и побочную. Главные подгруппы состоят из элементов всех периодов, а побочные — только из элементов больших периодов.
Контрольные вопросы
1. Чем отличаются короткий и длинный варианты Периодической системы химических элементов?
2. Что называют периодом, группой, главной и побочной подгруппой?
3. Как изменяются металлические и неметаллические свойства элементов в периодах? в главных группах?
4. Почему группы элементов в коротком варианте Периодической системы необходимо разделять на главные и побочные подгруппы?
Задания для усвоения материала
1. Назовите химические элементы I группы Периодической системы. Какие из них относятся к главной подгруппе, а какие — к побочной?
2. В четвертом периоде, пятой группе, главной подгруппе Периодической системы расположен: а) Силиций; б) Станнум; в) Арсен; г) Стибий.
3. Какие из следующих элементов относятся к главным, а какие — к побочным подгруппам: Нитроген, Оксиген, Гидроген, Купрум, Феррум, Алюминий?
4. Определите в каждом ряду один химический элемент, отличающийся от других местом в Периодической системе: а) H, He, Ne, Ar; б) Fe, Co, Ni, Ar; в) H, Li, Be, B; г) F, Cl, Br, Mn.
5. Какой химический элемент по свойствам подобен Силицию: а) Алюминий; б) Фосфор; в) Германий; г) Титан? Ответ поясните.
6. Составьте формулу высшего оксида и формулу летучего соединения с Гидрогеном (если она существует) для следующих элементов: а) Магний; б) Силиций; в) Рений; г) Осмий; д) Теллур; е) Радий.
7. У какого элемента сильнее выражены металлические (или неметаллические) свойства: а) у Бора или Алюминия; б) у Арсена или Нитрогена; в) Арсена или Стибия? Ответ обоснуйте.
8. Найдите в Периодической системе элемент, расположенный в четвертом периоде и проявляющий одинаковые валентности в высшем оксиде и в соединении с Гидрогеном.
9. Порядковые номера химических элементов А, Б, и В равны соответственно n, n + 2, n + 4.
1) Если химический элемент А — самый легкий галоген, то каким химическим элементом будет Б?
2) Если химический элемент В — инертный, а Б — металлический, то каким химическим элементом является А?
3) Если химические элементы А и Б принадлежат к одной группе, то каким химическим элементом является В?
4) Могут ли простые вещества, образованные А, Б и В, при обычных условиях быть газами?
10. Элементы А и Б относятся к I группе, а элемент В — к VII группе. Соединение элементов А и В растворимо в воде, а соединение элементов Б и В имеет белый цвет и нерастворимо в воде. Какими элементами могут быть А, Б и В?
11. Определите элемент, единственный оксид которого имеет относительную молекулярную массу 40 ± 1, а валентность — не больше IV. Докажите, что существует только один такой элемент.
12. Высший оксид элемента, образующий с Гидрогеном летучее соединение состава RH4, содержит 53,3 % Оксигена. Назовите этот элемент.
13. Элемент, высший оксид которого соответствует формуле RO3, образует соединение с Гидрогеном, содержащее 2,47 % Гидрогена. Назовите этот элемент.
14. Выполните учебный проект № 2 «Формы Периодической системы химических элементов».
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:26, Переглядів: 4518